Hořčík patří mezi kovy alkalických zemin, tvoří sloučeniny v oxidačním čísle +II. Na zemi je šestým nejhojnějším prvkem (2,76 %). Kovový hořčík se využívá jako konstrukční materiál v letectví.
| Atomové číslo | 12 | Počet stabilních izotopů | 3 |
| Atomová hmotnost | 24,3050 | Elektronová konfigurace | [Ne] 3s2 |
| Teplota tání [°C] | 650 | Teplota varu [°C] | 1091 |
| Elektronegativita | 1,20 | Hustota [g.cm-3] | 1,738 |

Izotopy
Je tvořen třemi stabilními izotopy, známe také 19 radioizotopů v rozmezí nukleonových čísel 18–41, nejdelší poločasy rozpadu mají 27Mg (9,44 minut) a 28Mg (20,92 hodin), oba se rozpadají mechanismem β−.
| Izotop | Zastoupení [%] |
| 24Mg | 78,99 |
| 25Mg | 10,00 |
| 26Mg | 11,01 |
28Mg
Tento izotop se využívá ke studiu metabolismu a chování hořčíku v živých organismech.
Připravuje se ostřelováním hliníku částicemi α, nebo ostřelováním hořčíku jádry tricia:
$$^{27}_{13}\textrm{Al}\ +\ ^4_2\textrm{He}\ \rightarrow\ ^{28}_{12}\textrm{Mg}\ +\ 3\ ^{1}_{1}\textrm{p} \\
^{26}_{12}\textrm{Mg}\ +\ ^3_1\textrm{H}\ \rightarrow\ ^{28}_{12}\textrm{Mg}\ +\ ^{1}_{1}\textrm{p}$$
Má poločas přeměny 20,9 hodin, přeměňuje se na 28Al mechanismem β–:
$$^{28}_{12}\textrm{Mg}\ \rightarrow\ ^{28}_{13}\textrm{Al}\ +\ ^{\ \ \ 0}_{-1}\beta^-$$
Výskyt a výroba
V přírodě se vyskytuje pouze v hořečnatých sloučeninách. Nejběžnějším minerálem je dolomit – MgCO3.CaCO3, vzácnější je magnezit MgCO3.

Hořčík se vyrábí ze sloučenin hořčíku elektrolýzou nebo termickou redukcí. Elektrolyticky se vyrábí z taveniny MgCl2, při termické redukci se využívá dolomot a ferrosilicium:
2 MgO·CaO + FeSi → 2 Mg + Ca2SiO4 + Fe
Využití
Hořčík je lehkým, konstrukčním kovem (hustota ρ = 1,74 g.cm-3), po železe a hliníku je třetím nejpoužívanějším konstrukčním kovem. Využívá se v letectví, ale i obalové technice, fotografických a optických zařízeních.

Při výrobě oceli se využívá ke snižování obsahu síry a slouží jako redukční činidlo při Krolově výrobě titanu:
TiCl4 + 2 Mg → 2 MgCl2 + Ti
Akumulátory založené na MgCl2
Jelikož je lithium poměrně drahé a hůře dostupné, hledají se alternativy k lithiovým bateriím. Jednou z novějších možností jsou akumulátory založené na hořčíku. Anodou je tenká hořčíkové fólie, katodou je hexakyanoželeznatan měďnatý (Cu2[Fe(CN)6]) smísený s SWCNT (jednostěnné uhlíkové nanotrubice) a polyvinyliden fluoridem (PVDF). Elektrolytem je vodný roztok chloridu hořečnatého (MgCl2).[7]
Chemické vlastnosti
Grignardova reakce
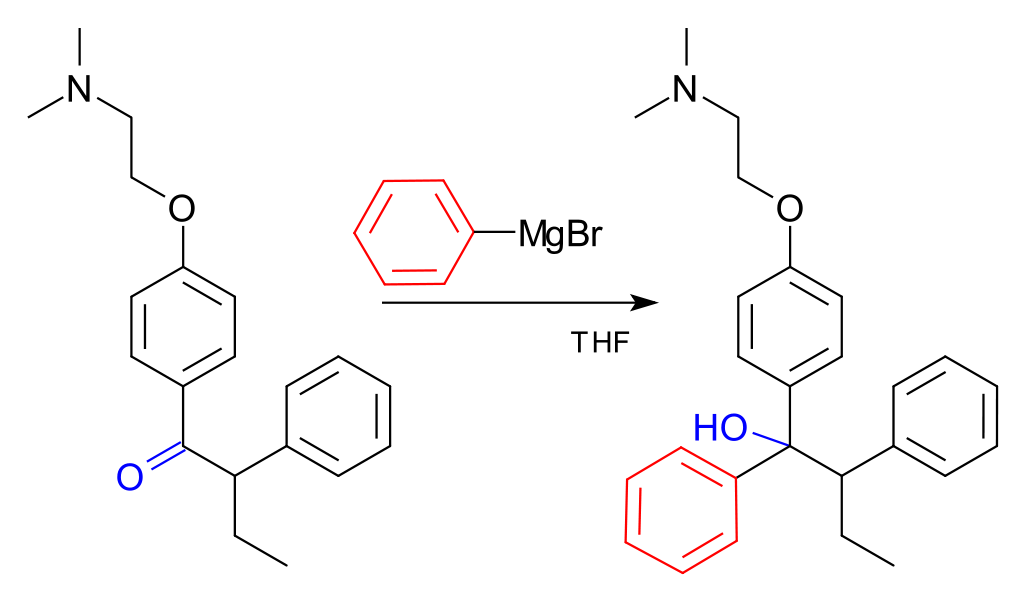
Velmi důležitým využitím organokovových sloučenin hořečnatých je Grignardova reakce, která se využívá pro tvorbu vazeb C-C a tím prodlužování uhlovodíkového řetězce. Grignardova činidla jsou alkyl- a arylmagnesiumhalogenidy, velmi často bromidy, např. CH3CH2MgBr – ethylmagnesiumbromid. Za objev těchto činidel byla roku 1912 udělena Nobelova cena francouzskému chemikovi Victoru Grignardovi.[5,6] Příkladem může být reakce acetylchloridu, z kterého získáme keton.

Grignardova činidla se připravují v diethyletheru nebo THF, reakcí kovového hořčíku s alkyl- nebo arylhalogenidy. Musíme pracovat v ochranné atmosféře, aby nedocházelo k hydrolýze. Reakce je nutné iniciovat jodem nebo 1,2-dibromethanem, který naruší vrstvu oxidu na povrchu hořčíku.
Grignardova reakce se využívá např. při výrobě léku Tamoxifenu.
Schlenkova rovnováha

V roztocích Grignardových činidel pozorujeme rovnováhu, kterou objevil německý chemik Wilhelm Schlenk. Jde o rovnováhu mezi Grignardovým činidlem a halogenidem hořečnatým a dialkyl nebo diarylmagnesiem:
2 RMgX ⇌ MgX2 + MgR2
NMR
V NMR je aktivní izotop 25Mg, který má v přírodě zastoupení 10 %. Jde o velmi málo citlivé jádro, které je navíc kvadrupolární, takže v případě sloučenin s nižší symetrií dochází k rozšiřování linií. Standardem pro NMR je chlorid hořečnatý (MgCl2).
| 25Mg | |
|---|---|
| Spin | 5/2 |
| Zastoupení v přírodě [%] | 10,0 |
| Citlivost vzhledem k 1H | 2,68 x 10-4 |
| Citlivost vzhledem k 13C | 1,58 |
| Rezonanční frekvence v poli 1 T | 2,6083 |
| Rozsah chemických posunů | -20 až 50 ppm |
Odkazy
- Hořčík na české wikipedii
- Hořčík na anglické wikipedii
- 25Mg NMR
- 25Mg Solid-State NMR of Magnesium Phosphates: High Magnetic Field Experiments and Density Functional Theory Calculations
- Victor Grignard
- Victor Grignard – Nobel Lecture
- Reversibility of a High-Voltage, Cl–-Regulated, Aqueous Mg Metal Battery Enabled by a Water-in-Salt Electrolyte
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
5 Replies to “Hořčík”