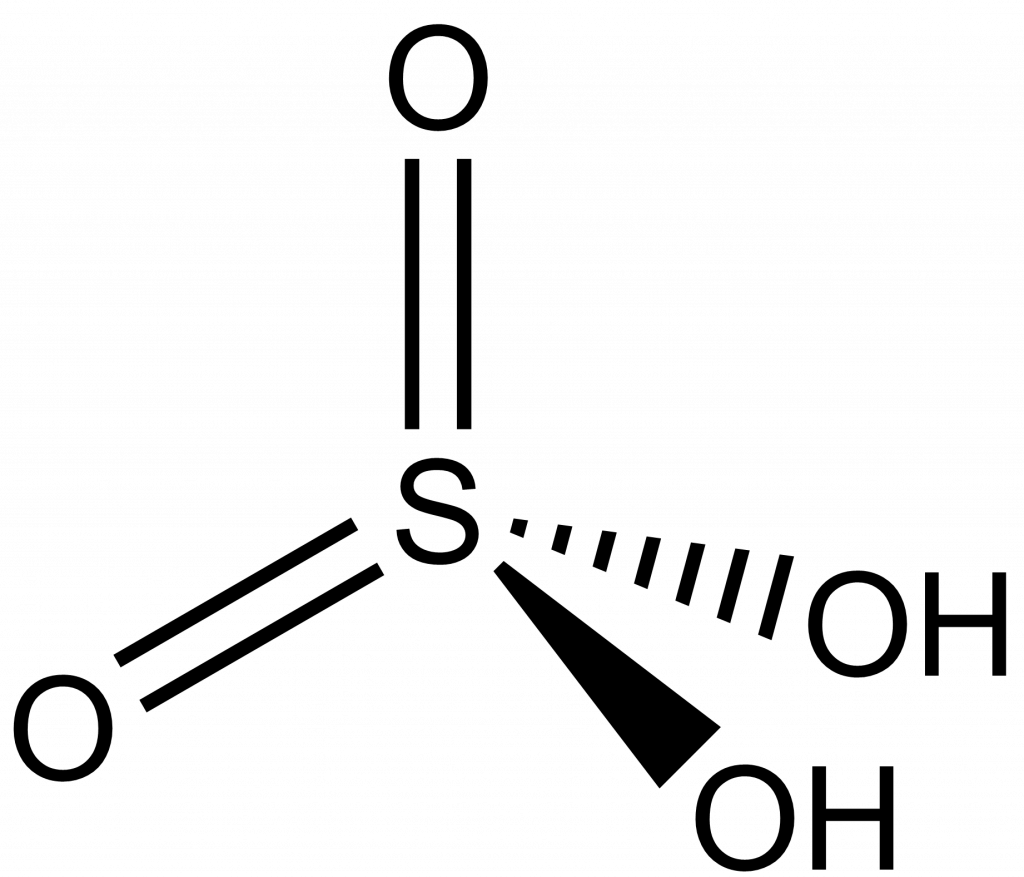
Kyselina sírová, H2SO4, je průmyslově nejdůležitější kyselinou síry. Celosvětově se jí vyrábí miliony tun ročně.
Hlavní využití nachází při výrobě kyseliny fosforečné (H3PO4) při výrobě hnojiv z fluoroapatitu:
Ca5(PO4)3F + 5 H2SO4 + 10 H2O → 5 CaSO4·2H2O + HF + 3 H3PO4
Mezi další využití kyseliny sírové patří čištění ocelových předmětů od rzi, ve směsi s peroxidem vodíku (H2O2) poskytuje tzv. piranha roztok, který je velmi účinným čistidlem. Využívá se např. v mikroelektronice nebo k čištění laboratorního skla.
Velké množství kyseliny sírové se spotřebuje při výrobě olověných akumulátorů.
Chemické vlastnosti

Je to silná, dvojsytná kyselina, která ve vodě zcela disociuje do obou stupňů:
H2SO4 + H2O → HSO4– + H3O+
HSO4– + H2O → SO42- + H3O+
Je to bezbarvá kyselina s vysokou hustotou (1,832 g.cm-3 při 20 °C). Je neomezeně mísitelná s vodou, ale při ředění se uvolňuje velké množství tepla a neopatrný postup může vést až k explozi. Ředění se správně provádí tak, že se pomalu vlévá kyselina do vody, roztok je nutné neustále míchat a pokud možno i chladit ledovou lázní.
Výroba
Výroba kyseliny sírové je velmi důležitý průmyslový proces, dříve se vycházelo ze síry, která se spalovala na SO2, dnes se spíše využívá oxid siřičitý z jiných procesů, např. z výroby kovové mědi. Oxid siřičitý není možné přímo oxidovat na SO3, musí se využít katalytický proces. Asi nejčastěji se využívá tzv. kontaktní způsob, kdy je katalyzátorem oxid vanadičný, V2O5. Ten je schopen za vysoké teploty uvolňovat kyslík a je možné ho zpětně regenerovat reakcí s plynným kyslíkem:
SO2 + V2O5 → SO3 + 2 VO2
4 VO2 + O2 → 2 V2O5
Vyrobený oxid sírový nelze přímo rozpouštět ve vodě, protože vzniká velmi obtížně kondenzovatelná mlha kyseliny sírové. Proto se nejprve pohlcuje do 98% kyseliny sírové za vzniku olea. Oleum je směs SO3 a kyseliny sírové, při vhodné koncentraci dochází ke vzniku kyseliny disírové:
SO3 + H2SO4 → H2S2O7
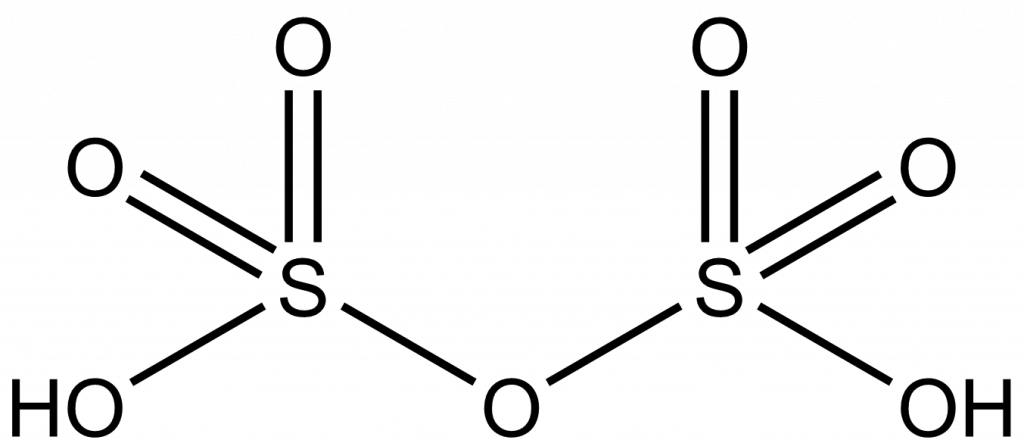
Oleum se poté ředí vodou zpět na kyselinu sírovou o koncentraci 96-98 %. Tato koncentrace je výhodná, protože způsobuje minimální korozi oceli, vznikající síran železnatý je totiž v koncentrované kyselině sírové nerozpustný. Také se snižuje riziko ztuhnutí kyseliny, 100% kyselina sírová má totiž teplotu tání 10 °C.
Historie
Historie kyseliny sírové je spjatá s Čechami, původní způsob výroby využíval jako výchozí sloučeninu zelenou skalici. To je heptahydrát síranu železnatého, FeSO4.7H2O, dříve se označovala také jako vitriolový kámen.

Důležitou surovinou pro výrobu síry byl pyrit, FeS2. Jeho zahříváním za nepřístupu vzduchu se uvolňovala síra, která byla lapána do vody. Rozkladem vznikají sulfidy železa s nižším obsahem síry, viz schéma:
FeS2 → FeSx + S8 (1≤x<2)
Zbytky po rozkladu se pak ukládaly do hromad, po dešti se pak v okolí hromad objevovaly zelené krystaly vitriolového kamene. Tepelným rozkladem síranu železnatého je možné získat přímo SO3, což je velmi výhodné, protože jeho zaváděním do zředěné kyseliny sírové můžeme snadno připravit kyselinu sírovou.
FeSO4 → FeO + SO3
Vyhneme se tak obtížné oxidaci oxidu siřičitého na sírový.
Jelikož koncem 18. století probíhala v Železných horách a dalších českých lokalitách intenzivní těžba pyritu, vyráběla se kyselina sírová dlouhou dobu u nás a zhruba století byla označována jako česká dýmavá kyselina sírová.
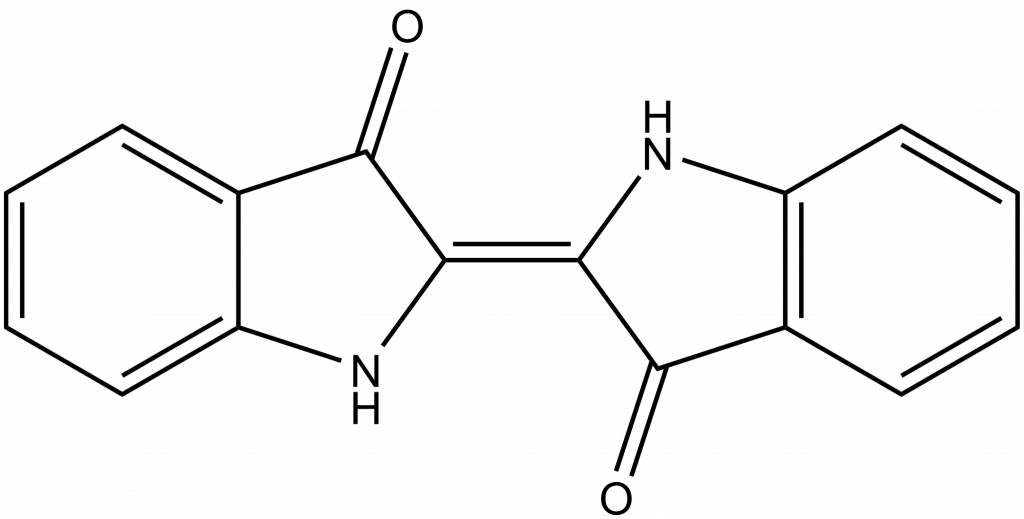
Kyselina sírová byla žádána, protože se využívala pro barvení textilu indigem. Indigo je přírodní modré barvivo získávané z Indigovníku. Pro barvení je nutné ho převést pomocí hydroxidu na rozpustnou a bezbarvou leukoformu, která pak oxidací vzduchem přejde zpět na modré barvivo.

Druhou možností je reakce indiga s koncentrovanou kyselinou sírovou, kdy dochází k sulfonaci molekuly a vzniká rozpustná forma, indigokarmín. Šlo vlastně o první syntetické barvivo.
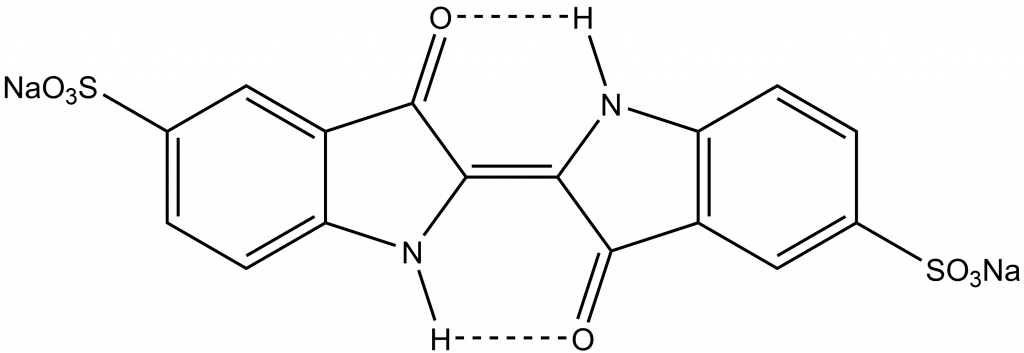
Díky tomuto procesu vzrostla poptávka po kyselině sírové a česká kyselina sírová se stala významným exportním produktem.
Literatura
- KAŠPAR, Miloš. Kyselina v zemském ráji. Vesmír. 2022, 692(11), 692-696. Dostupné také z: https://vesmir.cz/cz/casopis/archiv-casopisu/2022/cislo-11/kyselina-zemskem-raji.html