Chemická vazba je silová interakce, která k sobě poutá atomy v molekulách a iontech.
Charakteristiky chemické vazby
Chemickou vazbu lze popsat pomocí dvou parametrů: vazebné délky a vazebné energie. Vazebná délka je vzdálenost mezi atomovými jádry, řádově jde o pm, tzn. 10-9 m. Vazebná energie je energie, kterou potřebujeme na roztržení vazby a oddálení atomů do nekonečna, příp. energie, která se uvolní při vzniku vazby.
Vznik chemické vazby
Chemická vazba vzniká interakcí valenčních elektronů atomů. Aby vazba mohla vzniknout, musí být splněny dvě podmínky:
- Atomy se k sobě musí přiblížit tak, aby došlo k překrytí jejich valenčních atomových orbitalů.
- Počet, energie a prostorové uspořádání valenčních elektronů musí být vhodné, aby došlo ke vzniku vazebných elektronových párů.
Podle typu překryvu atomových orbitalů rozlišujeme tři typy vazeb.
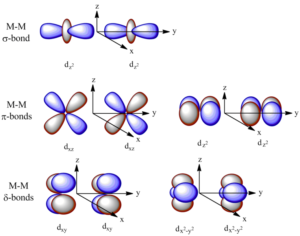
Vazba σ
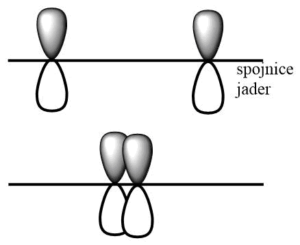
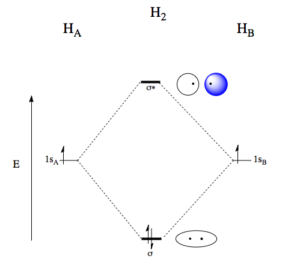
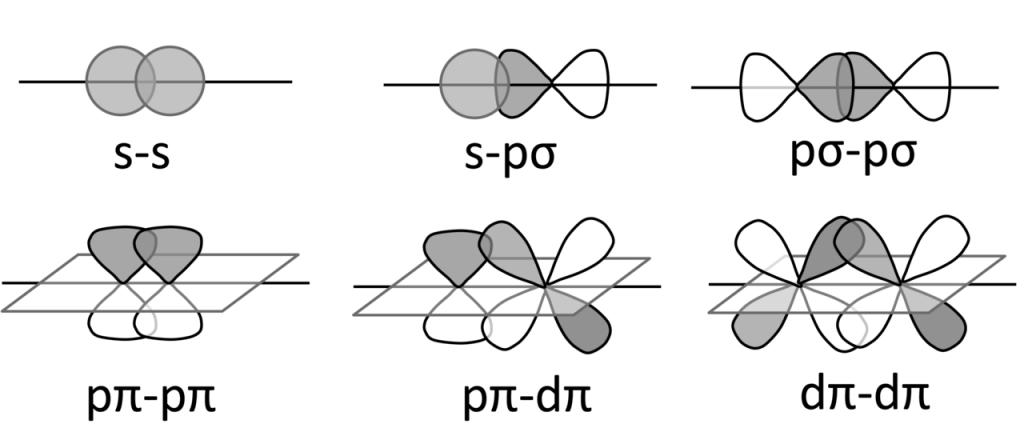
Při vzniku molekuly H2 dochází k překryvu valenčních 1s orbitalů obou atomů vodíku a vzniku dvou molekulových orbitalů, vazebného a protivazebného. Protože osa orbitalů je shodná s osou překryvu, jedná se o tzv, osový překryv a vzniká vazba σ.
Vazebný orbital zvyšuje řád vazby, s každým elektronem uvnitř vazebného orbitalu stoupá řád vazby o 1/2. Protivazebný orbital naopak řád vazby snižuje, má o jednu nodální plochu více než vazebný orbital a označujeme ho hvězdičkou, např. σ*. Vazebný orbital vzniká překryvem laloků atomových orbitalů se stejným znaménkem vlnové fukce, protivazebný pak překryvem orbitalů s opačnými znaménky vlnové funkce.
Vazba π
Vazbu π najdeme ve sloučeninách a dvojnou a vyšší vazbou, např. v ethenu (ethylenu).
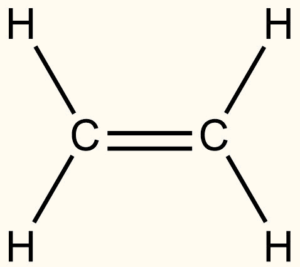
Vazba je tvořena dvěma vazebnými elektronovými páry, jeden vznikl σ překryvem a druhý je π vazebný pár, který vzníká bočným překryvem p-orbitalů.
Model vazebného a protivazebného π-orbitalu najdeme např. na commons, barvy označují znaménka vlnové funkce:
Vazba δ
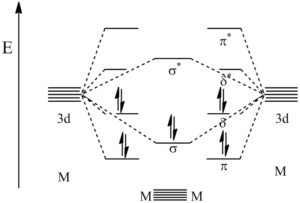
Vazba delta vzniká překryvem všech čtyř laloků d-orbitalů, nacházíme ji ve vazbách mezi ionty kovu, minimální řád vazby je 4. Příkladem může být paterná vazba mezi atomy chromu. Vazba je tvořena jedním σ-vazebným párem, dvěma π-vazebnými páry a dvěma δ-vazebnými páry, jak je ukázáno na diagramu:
Následující obrázek ukazuje vznik jednotlivých typů vazeb:
Formální náboj
Rozdíl mezi počtem valenčních elektronů ve volném atomu a valenčních elektronů ve vázaném atomu. Záporný náboj se umisťuje na atom s nejvyšší hodnotou elektronegativity.
Součet formálních nábojů všech atomů v molekule je roven jejímu náboji.
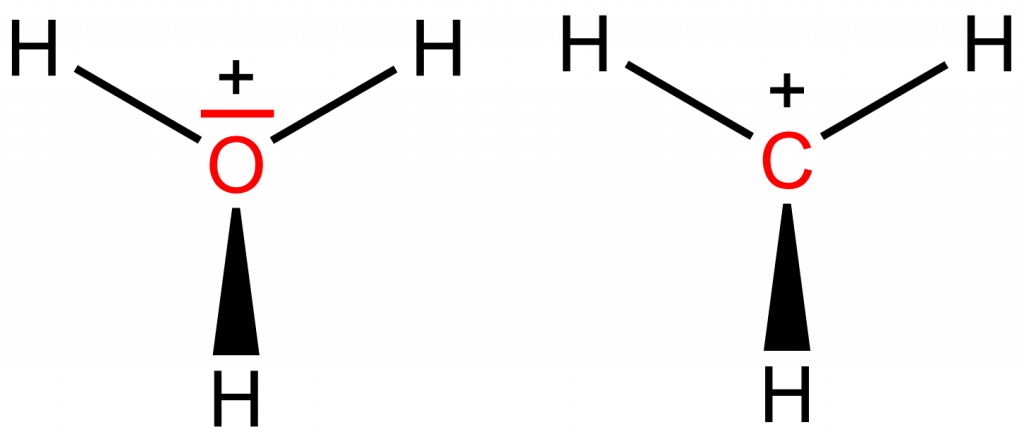
H3O+: H: 0; O: 6-5 = +1
CH3+: H: 0; O: 4-3 = +1
V oxoniovém iontu má kyslík celkem pět elektronů, tři tvoří vazby O-H a dva jsou nevazebné. V iontu CH3+ má uhlík tři elektrony z C-H vazeb, takže formální náboj uhlíku je +1.
Rezonanční struktury
Popisují polohy elektronů v molekulách, vyjadřují limitní stavy. Využívají se u molekul a iontů, které nelze popsat klasickými, rigidními vzorci. Jde jak o organické molekuly s π elektrony, tak i o anorganické molekuly s delokalizovanými elektrony.
Pravidla pro vytváření rezonančních struktur
- Ve strukturních vzorcích je nutné vyznačit vazby, nepárové elektrony, náboje a nejlépe i volné elektronové páry.
- Nelze měnit polohu atomů a jejich vazebné umístění (tzn. nelze přesouvat σ-vazby).
- Mohou se přemisťovat pouze π-elektrony, nepárové elektrony a volné elektronové páry.
- Součet všech π-elektronů, nespárovaných elektronů a volných elektronových párů musí být stejný. Také celkový náboj molekuly musí být stejný.
- Musí být dodrženo „oktetové pravidlo“: součet všech elektronů v „širokém“ okolí atomu (platí hlavně pro prvky druhé periody) musí být rovno 8.
- Posouváme minimální možný počet elektronů na co nejmenší vzdálenosti. Větší posuny rozdělíme na kratší kroky. Změnu je vhodné vyznačit šipkou.
- Ekvivalenci rezonančních struktur značíme obousměrnou šipkou ↔.
Řád vazby
Řád vazby je počet vazeb mezi atomy, nemusí být nutně celočíselný. Např. v molekule H-H je řád vazby 1, v molekule O=C=O mají obě vazby řád 2. Řád vazby (RV) můžeme spočítat podle jednoduchého vztahu:
$$\textrm{RV} = \frac{\textrm{počet vazebných elektronů – počet protivazebných elektronů}}{2}$$
Počet vazebných elektronů odpovídá počtu elektronů ve vazebných orbitalech, počet protivazebných elektronů odpovídá počtu elektronů v protivazebných orbitalech. Molekula vodíku má dva elektrony ve vazebném σ-orbitalu a žádný v protivazebném, řád vazby je tedy:
$$\textrm{RV} = \frac{2 – 0}{2} = 1$$
Pokud z molekuly H2 vyrobíme anion H2–, tzn. přídáme jeden elektron, změní se i řád vazby. Elektron musíme umístit do protivazebného σ-orbitalu, takže vztah se změní:
$$\textrm{RV} = \frac{2 – 1}{2} = 0,5$$
Řád vazby tedy nemusí být celočíselný.
Druhy chemických vazeb
Jednoduchá
Vazba je tvořena jedním σ-vazebným elektronovým párem, příkladem jsou vazby C-C a C-H v alkanech.
Dvojná
Vazba je tvořena jedním σ-vazebným elektronovým párem a jedním π-vazebným elektronovým párem, příkladem je vazba C=C v alkenech.
Trojná
Vazba je tvořena jedním σ-vazebným elektronovým párem a dvěma π-vazebnými elektronovými páry, které jsou na sebe kolmé. Příkladem je vazba C≡C v alkynech.
V roce 2025 byla poprvé připravena trojná vazba mezi uhlíkem a borem.
Čtverná vazba
Čtverná vazba byla poprvé pozorována u sloučeniny rhenia K2[Re2Cl8] syntetizované už roku 1965. Je tvořena jednou vazbou σ, dvě vazbami π a jednou vazbou typu δ.
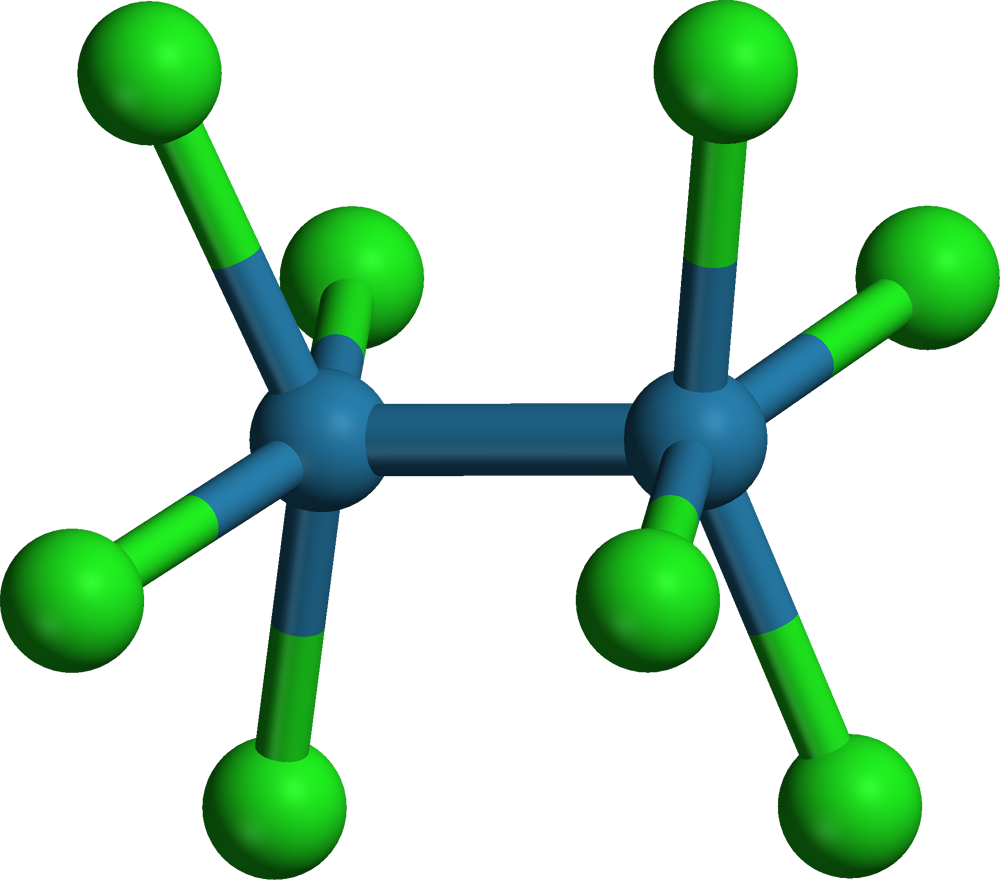
Vazba δ vzniká překryvem čtyř laloků d-orbitalů.
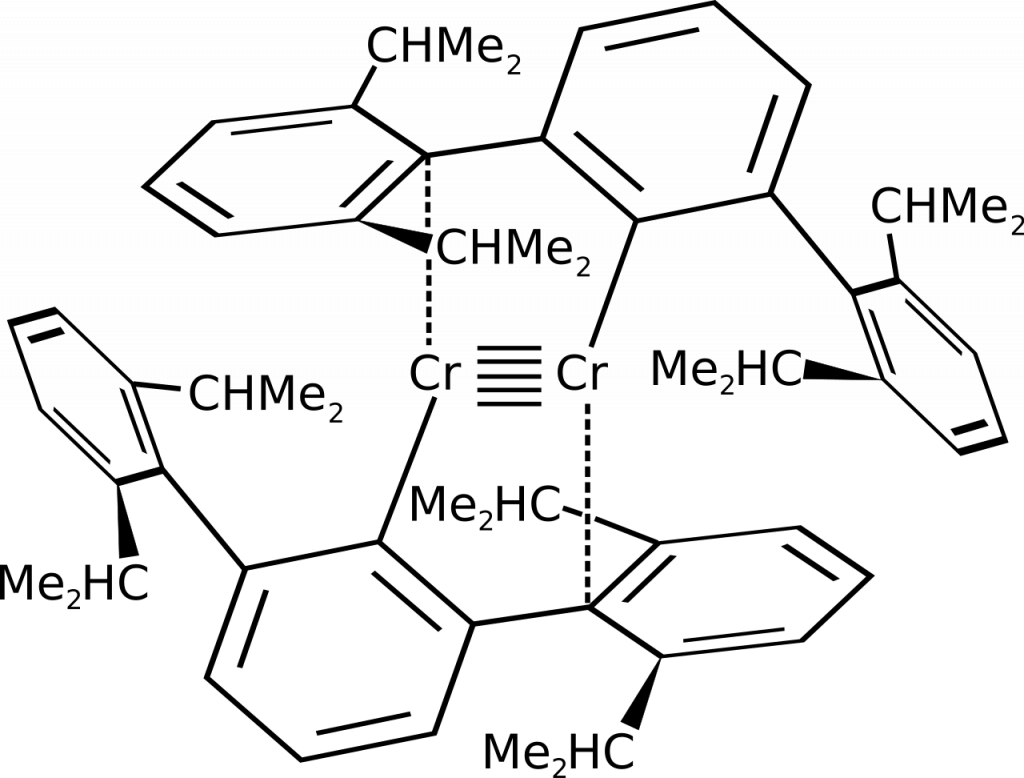
Paterná vazba
Tento typ vazby byl poprvé posán v roce 2005 u sloučeniny chromu připravené redukcí dimerní sloučeniny pomocí draselného interkalátu grafitu. Pro stabilizaci této vazby je nutné použít objemný ligand, např. (2,6-[(2,6-diisopropyl)fenyl]fenyl).[1]
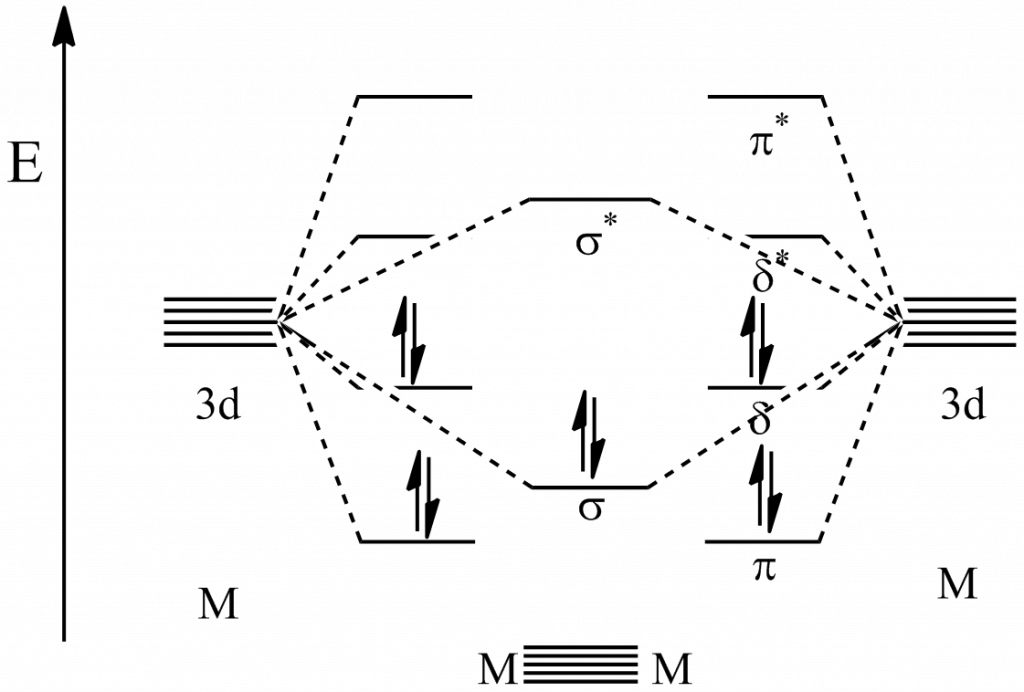
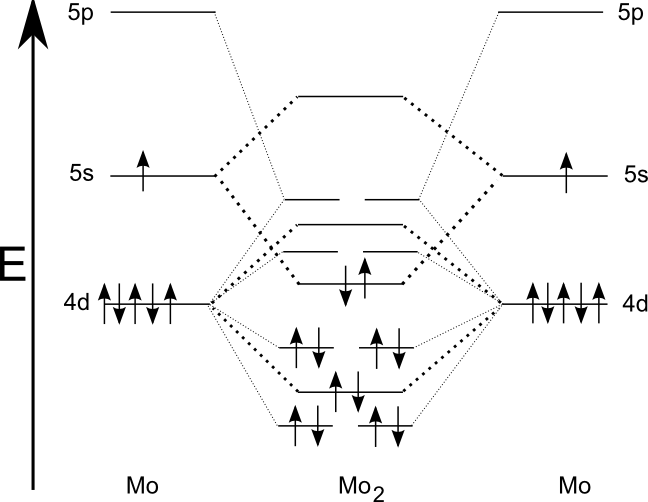
Šesterná vazba
S šesternou vazbou se potkáváme v molekule dimolybdenu (Mo2) nebo diwolframu (W2), ty známe pouze v plynné fázi. Vazba je tvořena 12 elektrony, všechny jsou umístěny ve vazebných orbitalech. Formálně je tedy řád vazby opravdu 6. Zjištěný efektivní řád vazby je pochopitelně nižší, pro obě molekuly je 5,2, z čehož plyne, že se jedná o paternou vazbu s částečným příspěvkem šesterné.
Aromatické sloučeniny
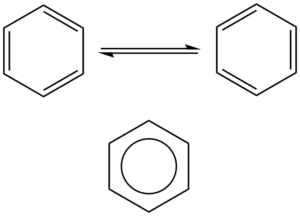
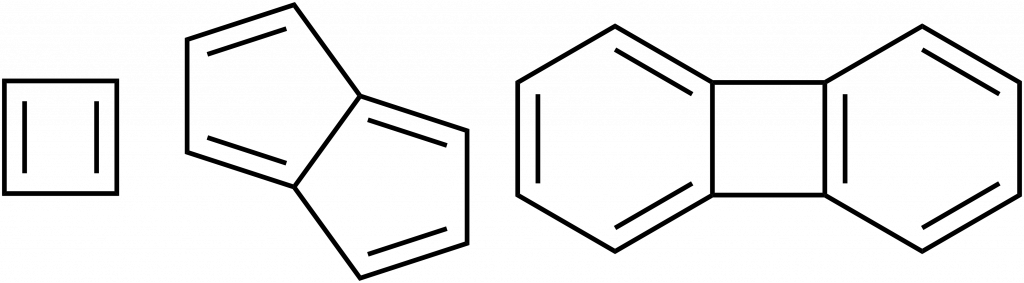
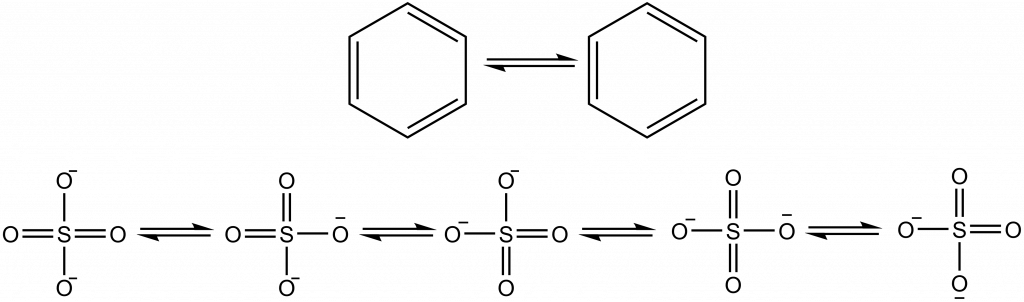
Aromatické sloučeniny obsahují cykly, kde se pravidelně střídají jednoduché a dvojné vazby, nejběžnějším příkladem je benzen. Na obrázku dole jsou znázorněny mezomerní struktury benzenu a správnější zobrazení, kde je aromatický systém zobrazen jako kruh uvnitř šestičlenného cyklu:
Mezomerní struktury zobrazují benzen jako cyklohexa-1,3,5-trien, ale strukturní data nám ukáží, že všechny vazby jsou rovnocenné, jejich řád je neceločíselný. Benzen je tvořen 12 σ-vazbami, šesti C-H a šesti C-C. Zbývajících šest elektronů je v orbitalech p atomů uhlíku, tyto elektrony vytvoří delokalizované molekulové orbitaly, které jsou umístěna nad a pod rovinou benzenového kruhu.
Při vzniku aromatického systému se uvolňuje tzv. stabilizační energie, tím je toto uspořádání energeticky výhodné a je preferováno. Aby byl systém aromatický musí splňovat následující podmínky:
- Aromatický systém musí být planární (rovinný)
- Musí obsahovat konjugovaný systém násobných vazeb – musí se střídat jednoduchá a dvojná vazba
- Počet π-elektronů musí splňovat Hückelovu podmínku, tj. musí být roven výrazu 4n+2, kde n je 0 nebo kladné celé číslo
Pokud počet π-elektronů odpovídá výrazu 4n, jde o systém antiaromatický.
Antiaromatické sloučeniny
Antiaromatické sloučeniny, podobně jako aromatické, obsahují cykly, kde se střídají dvojné a jednoduché vazby. Ale jejich počet π-elektronů odpovídá výrazu 4n, např. 4, 8, 12, atd. Na rozdíl od aromatických sloučenin, jsou antiaromatické sloučeniny nestabilní a velmi reaktivní.
Třístředová dvouelektronová vazba
Tato vazba je poměrně běžná u sloučenin boru, např. můstková vazba B-H-B v boranech. Struktura diboranu je na obrázku dole.
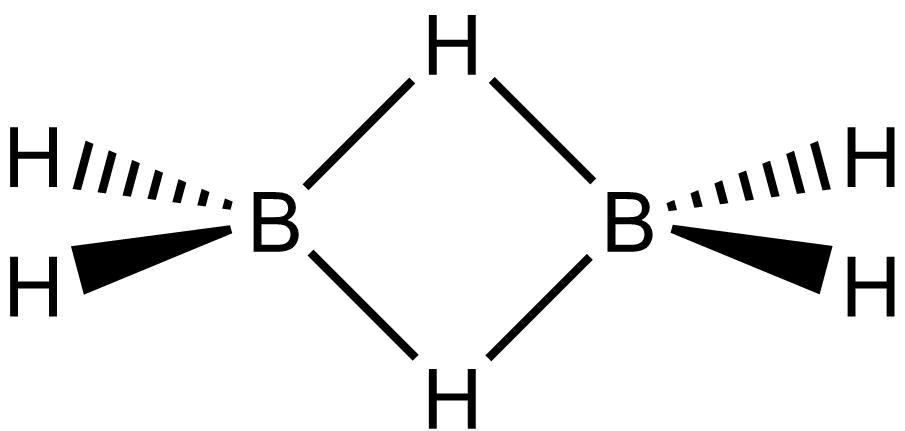
Pokud spočítáme valenční elektrony dojdeme k počtu 12:
každý bor má tři a vodík jeden: 2×3 + 6×1 = 12.
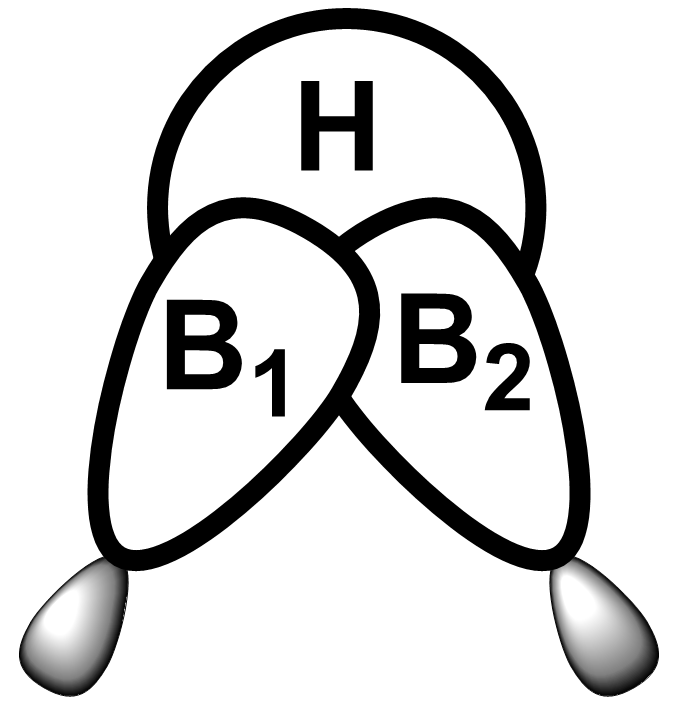
Struktura obsahuje osm vazeb, což by vyžadovalo 16 elektronů. Oba můstky jsou ale tvořeny pouze dvěma elektrony, tím se dostaneme na počet 12. Proto tyto vazby označujeme jako třístředové (BHB) dvouelektronové. Řád můstkové vazby B-H je 0,5, proto je slabší a delší než terminální vazba B-H. Uspořádání orbitalů v této vazbě je ukázáno na obrázku dole.
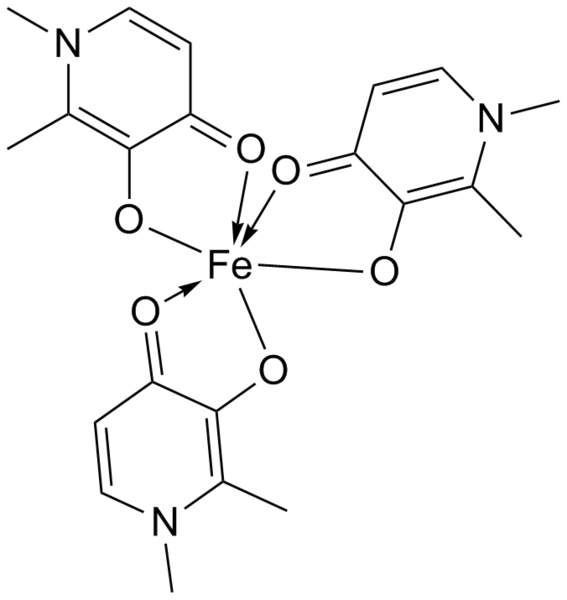
Koordinační (dativní)
Vazba v komplexních sloučeninách, centrální atom poskytuje volný orbital a ligand nevazebný elektronový pár.
Iontová vazba
S touto vazbou se setkáváme v případě, kdy je rozdíl elektronegativit prvků větší než 1,7. Klasickým příkladem je chlorid sodný, NaCl. Díky velkému rozdílu elektronegativit dochází k přesunu jednoho nebo více elektronů od elektropozitivnějšího prvku v elektronegativnějšímu.
Sodík má hodnotu elektronegativity 0,93, chlor 3,16. Při vzniku chloridu sodného dochází tedy k (formálnímu) přesunu jednoho elektronu ze sodíku na chlor. Z neutrálních atomů vznikají ionty, sodný (Na+) a chloridový (Cl–). Tyto ionty jsou pak k sobě vázány elektrostatickými silami.
Iontové sloučeniny jsou zpravidla dobře rozpustné ve vodě.
Parametry vybraných vazeb
| Vazba | Vazebná délka [pm] | Vazebná energie [kJ.mol-1] |
|---|---|---|
| H-H | 74 | 436 |
| H-F | 92 | 568 |
| H-Cl | 127 | 432 |
| H-Br | 141 | 366 |
| H-I | 161 | 298 |
| C-C | 154 | 347 |
| C=C | 134 | 614 |
| C≡C | 120 | 839 |
| N-N | 145 | 170 |
| N≡N | 110 | 945 |
| O-O | 148 | 145 |
| F-F | 142 | 158 |
| C-N | 147 | 308 |
| C=N | 129 | 613 |
| C≡N | 116 | 887 |
| C-O | 143 | 360 |
| C=O | 120 | 799 |
| C≡O | 113 | 1072 |
| C-S | 182 | 272 |
| C-F | 135 | 488 |
| C-Cl | 177 | 330 |
Odkazy
Další kapitoly
- České chemické názvosloví
- Platné číslice a měření
- Základní chemické zákony
- Důležité veličiny a vztahy v chemii
- Výpočet stechiometrického vzorce
- Chemické rovnice a stechiometrické výpočty
- Koncentrace roztoků
- Rozpustnost, součin rozpustnosti
- Stavba atomu
- Periodická tabulka prvků a periodicita vlastností
- Chemická vazba
- VSEPR
- Komplexní sloučeniny
- Magnetické vlastnosti látek
- Termodynamika
- Chemická rovnováha
- Skupenské stavy látek
- Fázové rovnováhy
- Teorie kyselin a zásad
- pH, aktivita roztoku
- Elektrochemie
- Symetrie molekul
- Laboratorní technika
- Lineární regrese
- Jednotky tlaku
- Jednotky teploty
- Mohsova stupnice tvrdosti minerálů
- Odkazy
- Prezentace k semináři z obecné chemie