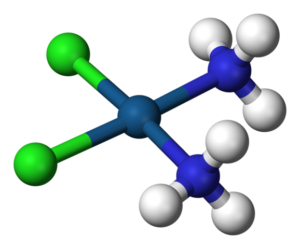
Komplexní sloučeniny jsou chemické sloučeniny, které obsahují alespoň jednu koordinační (dativní) vazbu. Obvykle jde o sloučeniny přechodných kovů. Kov je obklopen ligandy, často organickými.
Historie

Koordinační sloučeniny jsou známy již velmi dlouhou dobu, ale jejich struktura byla až donedávna záhadná. Chemiky dlouho mátlo, že jejich složení neodpovídá oxidačním číslům prvků a že jednotlivé skupiny, z nichž se komplex skládá nelze prokázat důkazovými reakcemi.
Počátek koordinační chemie je spjat se jménem Alfreda Wernera. Ten v roce 1893 zavedl správný model koordinačních sloučenin, kdy je centrální atom obklopen ligandy, např. chlorid hexaamminkobaltitý byl nesprávně zapisován jako CoCl3·6NH3, Werner zavedl správný zápis [Co(NH3)6]Cl3.
Strukturu solvátů chloridu kobaltitého odhalil s využitím srážecí reakce s AgNO3, např.:
[Co(NH3)6]Cl3 + 3 AgNO3 → 3 AgCl + [Co(NH3)6](NO3)3
[Co(NH3)5Cl]Cl2 + 2 AgNO3 → 2 AgCl + [Co(NH3)5Cl](NO3)2
Při disociaci dochází k uvolnění pouze těch chloridových iontů, které nejsou koordinovány ke kobaltu.
| Sloučenina | Barva | Molů AgCl | Komplex |
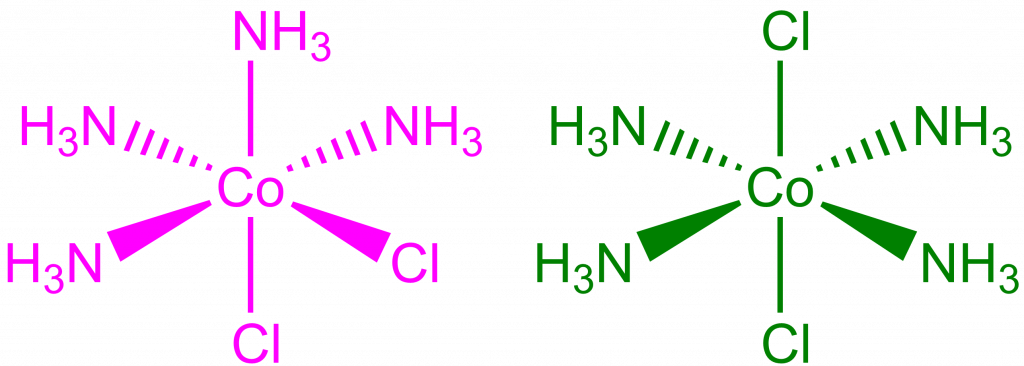
| CoCl3 . 4 NH3 | Fialová | 1 | cis-[Co(NH3)4Cl2]Cl |
| CoCl3 . 4 NH3 | Zelená | 1 | trans-[Co(NH3)4Cl2]Cl |
| CoCl3 . 5 NH3 | Purpurová | 2 | [Co(NH3)5Cl]Cl2 |
| CoCl3 . 6 NH3 | Žlutá | 3 | [Co(NH3)6]Cl3 |
Protože od chloridu tetraammin-dichlorokobaltitého existují dva izomery s rozdílnou barvou odvodil, že musí mít oktaedrickou geometrii. Jde o izomery cis- a trans-.
Werner zavedl pojem hlavní a vedlejší valence, hlavní odpovídala oxidačnímu číslu centrálního atomu, vedlejší pak obsahovala zbylé ligandy. Tento koncept se později ukázal jako nesprávný.
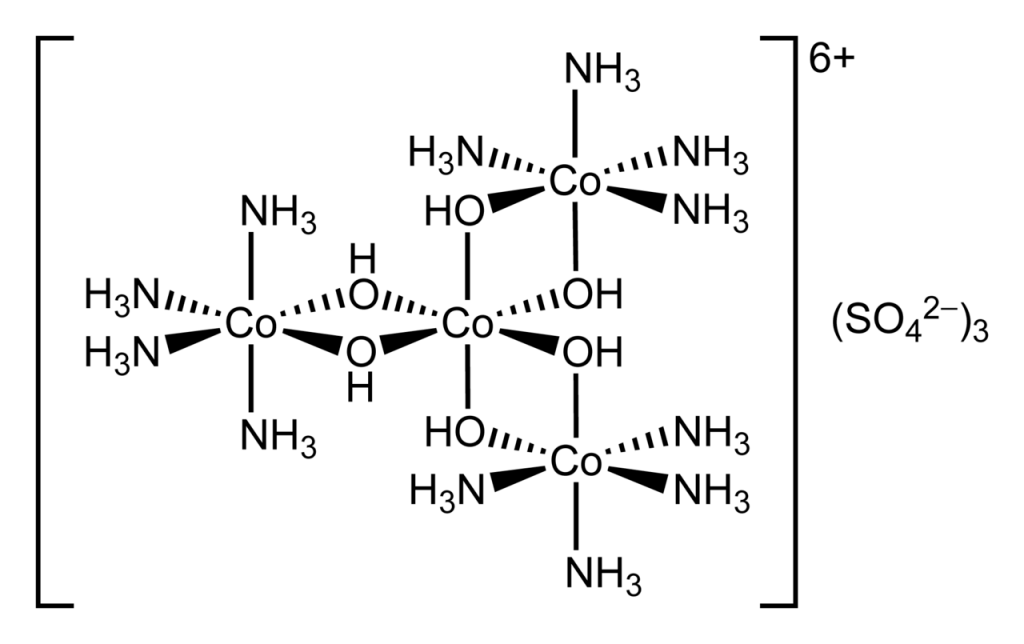
V roce 1914 Werner objevil první chirální koordinační sloučeninu – hexol, jehož vzorec je {[Co(NH3)4(OH)2]3Co}(SO4)3.
Koordinační vazba
Koordinačně-kovalentní, nebo donor-akceptorová vazba je dvouelektronová chemická vazba, kde oba elektrony pocházejí z jednoho atomu (donoru) a druhý atom (akceptor) poskytuje volný orbital, pro tyto elektrony.
Například u hexaamminkobaltitého komplexu je kobaltitý ion obklopen šesti molekulami amoniaku, každý amoniak poskytuje volný elektronový pár, který nese atom dusíku.
Ligandy
Ligandy jsou ionty nebo molekuly, které se váží na centrální atom, za vzniku koordinační sloučeniny. Vazba ligandu ke kovu vzniká donací minimálně jednoho elektronového páru z ligandu. Řád vazby ligandu ke kovu se pohybuje v rozmezí od jedné do tří. Ligandy nejčastěji vystupují jako Lewisovy kyseliny, méně často jako Lewisovy báze.
Ligandy dělíme podle mnoha různých hledisek, zatím se podíváme na dvě: denticitu a hapticitu.
Denticita
Denticita vyjadřuje počet donorových atomů, kterými je ligand vázán k centrálnímu atomu.
Monodentátní ligandy – jsou vázány jedním atomem k centrálnímu kovu, např. NH3, OH–, atd.
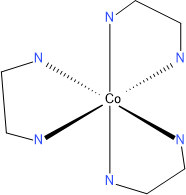
Bidentátní ligandy – jsou vázány dvěma atomy k centrálnímu kovu, např. ethylendiamin (en).
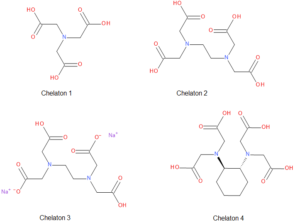
Vícedentátní (polydentátní) ligandy – sem patří především tzv. chelatony, což jsou sloučeniny, které se využívají při chelatometrických titracích, jejich struktura obsahuje dostatečný počet donorových atomů, aby dokázaly komplexovat libovolný kov v poměru 1:1.
- Chelaton 1 – kyselina nitrilotrioctová, NTA
- Chelaton 2 – kyselina ethylendiamintetraoctová, EDTA
- Chelaton 3 – disodná sůl kyseliny ethylendiamintetraoctové
- Chelaton 4 – monohydrát kyseliny 1,2-diaminocyklohexan-N,N,N‘,N‘-tetraoctové
Mezi polydentátní ligandy patří i makrocykly, např. hem, který je součástí hemoglobinu, kde komplexuje ion železa.
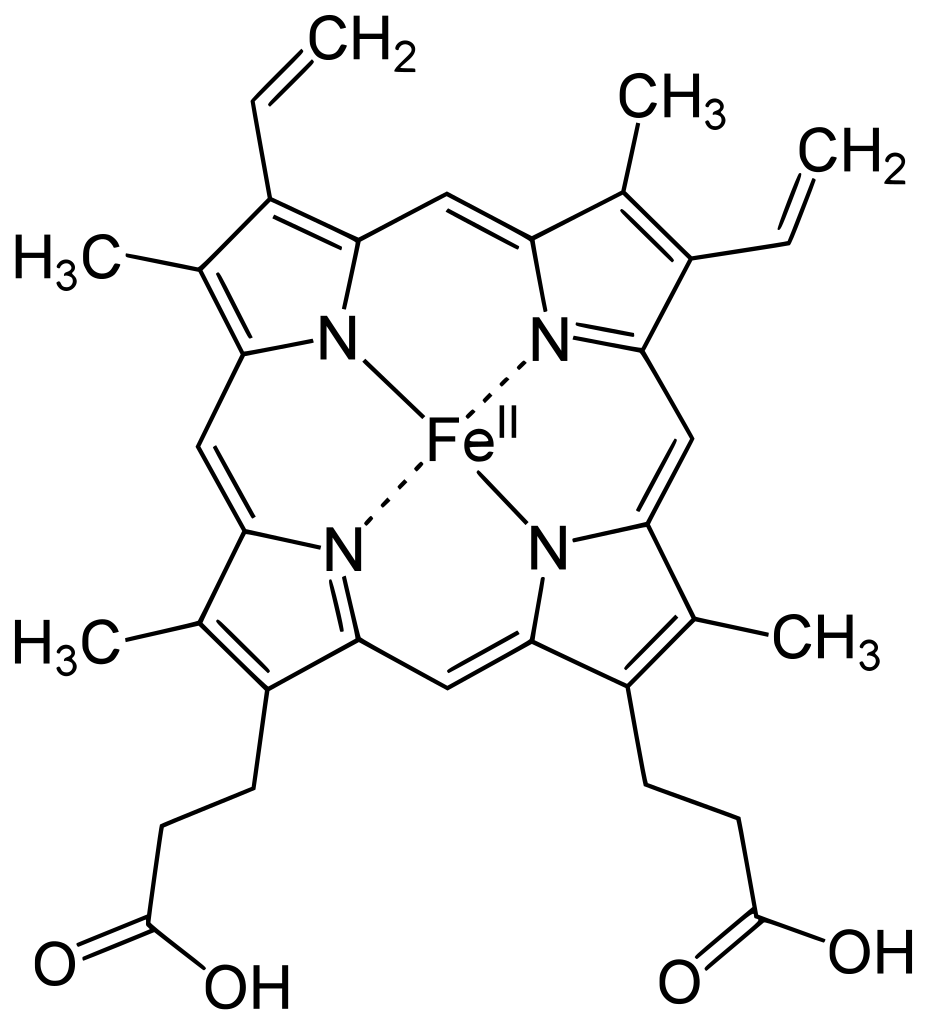
Hapticita
Hapticita vyjadřuje velikost (počet atomů) π-systému ligandu, kterým je vázán k centrálnímu atomu. Značí se řeckým písmenem eta (η). Např. u ferrocenu, kde je železnatý ion komplexován dvěma cyklopentadienylovými anionty, je vazba vytvářena mezi železnatým iontem a celým π systémem aniontu, proto anion označujeme jako η5-cyklopentadienyl.
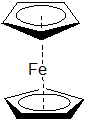
Dalšími ligandy, které se koordinují pomocí svého π-systému jsou např. ethylen, butadien a benzen. Ne vždy se musí vazby zúčastnit celý π-systém ligandu, např. butadien se může koordinovat jak η4, tak i η2.
Názvosloví koordinačních sloučenin
Izomerie koordinačních sloučenin
Izomerie je jev, kdy mají sloučeniny stejný sumární vzorec, ale jiné uspořádání atomů. U komplexů se setkáváme s mnoha druhy izomerií, tady se podíváme na geometrickou, optickou, ionizační, vazebnou a koordinační izomerii.
Geometrická izomerie
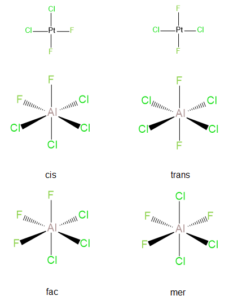
Nejčastěji se vyskytuje u čtvercových a oktaedrických komplexů, pokud stejné ligandy obsazují vedlejší pozice, jde o izomer cis, pokud jsou v protilehlých pozicích, jde o izomer trans. U oktaedrických komplexů s obecným složením Ma3b3 se setkáváme s izomery fac, kde jsou stejné donorové atomy na jedné stěně oktaedru a mer, kde jsou donorové atomy na obvodu oktaedru.
Optická izomerie
Optické izomery, enantiomery, jsou dvojice molekul, příp. iontů, které jsou svým zrcadlovým odrazem, mají se k sobě jako levá a pravá ruka. Jejich fyzikální a chemické vlastnosti jsou stejné, kromě smyslu stáčení roviny polarizovaného světla. Jeden z izomerů ji stáčí doleva (označuje se l nebo -) a druhý doprava (d nebo +). Nověji se označují pomocí symbolů R a S.
Tuto izomerii najdeme u oktaedrických komplexů s bidentátními ligandy, např. [Co(en)3]Cl3.
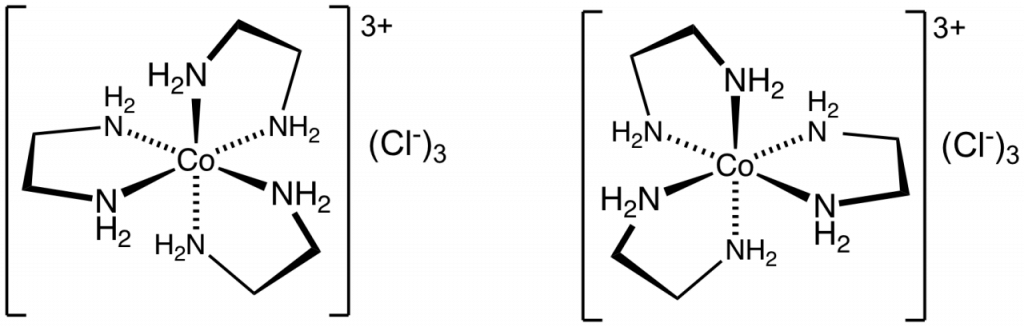
Ionizační izomerie
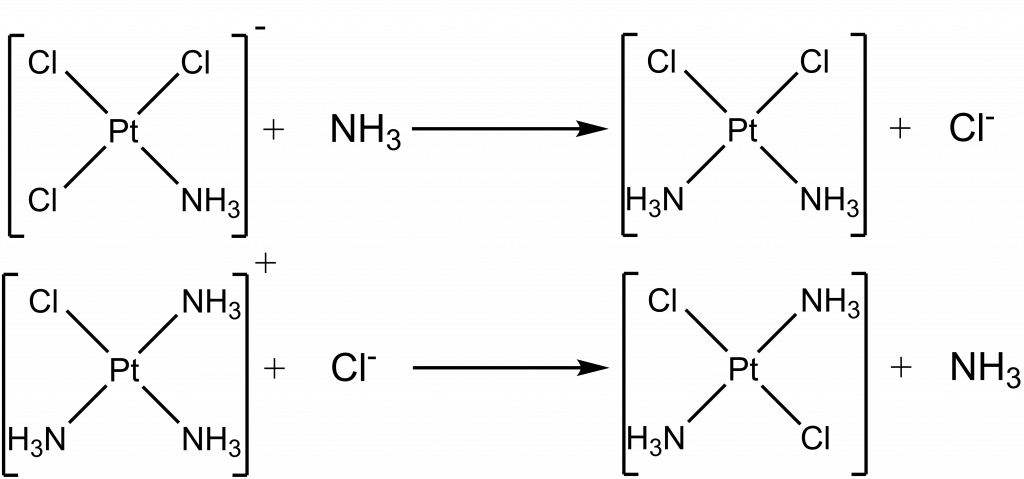
Tyto izomery se liší uspořádáním iontů v koordinačních sférách, jde například o dvojici látek [Pt(NH3)4Cl2]Br2 a [Pt(NH3)4BrCl2]Cl2, po rozpuštění tyto látky disociují za vzniku odlišných iontů. Podobně můžeme klasifikovat i některé hydráty, např. CrCl3·6H2O existuje ve třech různých formách: [Cr(H2O)6]Cl3, [Cr(H2O)5Cl]Cl2·H2O a [Cr(H2O)4Cl2]Cl·2H2O.
Vazebná izomerie
Pozorujeme ji u komplexů s ligandy, které mají více donorových atomů. Jednotlivé izomery se liší atomem, kterým je ligand vázán k centrálnímu atomu, např. dvojice komplexů [Co(NH3)5NO2]Cl2 a [Co(NH3)5ONO]Cl2. První je chlorid pentaamminnitrokobaltitý, kde je NO2– skupina vázána přes atom dusíku a druhý chlorid pentaamminnitritokobaltitý, kde je NO2– skupina vázána přes kyslíkový atom (ONO–). Donorový atom se podle konvence píše vždy první, aby bylo možné izomery odlišit i ve vzorci.
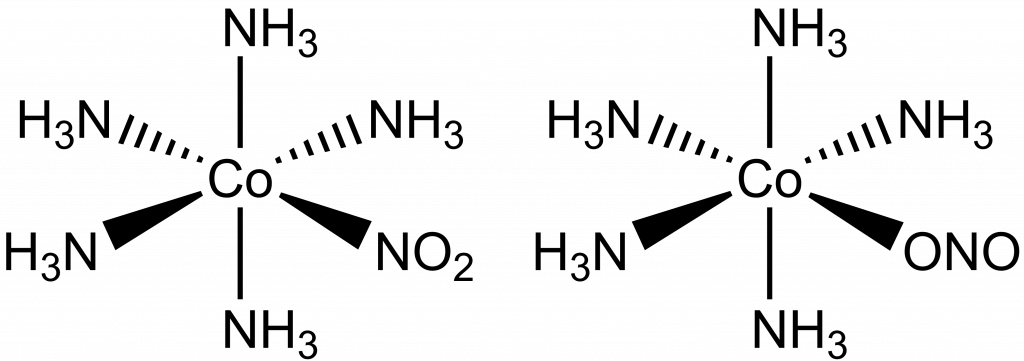
Koordinační izomerie
Týká se sloučenin, které mají komplexní jak anion, tak i kation, potom mohou vznikat dvojice izomerů, které se liší uspořádáním ligandů, např.: [Cu(NH3)4][PtCl4] a [CuCl4][Pt(NH3)4]. Tyto látky se pochopitelně liší jak fyzikálními, tak i chemickými vlastnostmi.
Konstanta stability komplexů
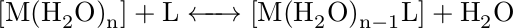
Konstanta stability je rovnovážná konstanta popisující vznik komplexu v roztoku. Odvození si můžeme demonstrovat na jednoduché rovnici:
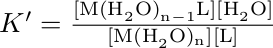
Roztok hydratovaného iontu kovu reaguje s ligandem, za vzniku vazby kov-ligand a uvolnění molekuly vody. Rovnovážná konstanta pro tento děj má tvar:
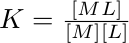
Hranaté závorky označují rovnovážné koncentrace látek. Za předpokladu, že voda (rozpouštědlo) je v nadbytku a samotnou reakcí se její koncentrace mění pouze zanedbatelně, lze vztah pro rovnovážnou konstantu upravit na konstantu stability:
Konstanty stability se často uvádějí i pro jednotlivé rovnováhy, např. pro komplex tetraamminkademnatý [Cd(NH3)4]2+, najdeme čtyři rovnováhy a tedy i čtyři konstanty stability.
Úhrnná konstanta stability (β) je rovna součina dílčích konstant.
β = K1·K2·K3·K4 = 106,56
Cheláty a chelátový efekt
Cheláty jsou komplexy kovů s vícedentátními ligandy. Chelátový efekt je zvýšená afinita multidentátních ligandů ke kovu, v porovnání s afinitou podobných monodentátních ligandů ke stejnému kovu. Můžeme si to ilustrovat na reakcích měďnatého iontu s amoniakem a ethylendiaminem (en):
Cu[(H2O)6]2+ + 3 en ↔ [Cu(en)3]2+ + 6 H2O
Cu[(H2O)6]2+ + 6 NH3 ↔ [Cu(NH3)6]2+ + 6 H2O
![Struktura iontů [Cu(NH3)6]2+ a [Cu(en)3]2+](http://z-moravec.net/wp-content/uploads/3125/02/komplexy-chelaty.png)
Rovnovážná konstanta je úměrná Gibbsově energii (ΔG0) podle vztahu:
ΔG0 = −RT ln K = ΔH0 − TΔS0
Entalpie je u těchto dvou reakcí přibližně stejná, proto je vyšší stabilita chelátů způsobena entropickým členem.[2] Tomu odpovídají i rovnice tvorby chelátu a komplexu s amoniakem. Jiné vysvětlení tohoto efektu vypracoval v roce 1952 G. Schwarzenbach.[3] Pokud máme ve vodném roztoku přítomný jak monodentátní ligand (L), tak i bidentátní (L-L) je pravděpodobnost navázání jednoho z nich na centrální atom (vytvoření vazby M-L) stejná pro oba ligandy, ale po navázání jednoho donorového atomu z bidentátního ligandu je druhý donorový ligand držen v blízkosti centrálního atomu, jeho efektivní koncentrace je tím vyšší než pro monodentátní ligand a tím je i vyšší pravděpodobnost vytvoření chelátu.
Chelátový efekt je nejvýraznější pro pěti- a šestičlenné cykly, kde dochází k nejmenší deformaci vazebných úhlů ligandů.
Vysoké stability chelátových komplexů se využívá v chelatometrii.
Teorie krystalového pole (CFT)
Popisuje vazebné poměry v koordinačních sloučeninách, formulovali ji ve 30. letech 20. století Hans Bethe a John Hasbrouck van Vleck. Interakce mezi ligandem a centrálním kovem je popisována pomocí elektrostatiky, ligandy jsou chápány jako negativní bodové náboje a kov jako kladný náboj. Vazba je realizována pomocí d-orbitalů kovu, které jsou v nevázaném iontu energeticky degenerované, tzn. mají stejnou energii. Po vytvoření komplexu dojde, v závislosti na tvaru komplexu, k jejich rozštěpení na dvě skupiny. Velikost rozštěpení (rozdíl energií) je dána několika faktory:
- povahou a oxidačním stavem kovového iontu, čím je vyšší oxidační stav kovu, tím pozorujeme i silnější štěpení
- geometrickým uspořádáním ligandů okolo centrálního kovu
- povahou ligandu, čím silněji ovlivňuje ligand centrální kov, tím bude štěpení silnější
Sílu štěpení můžeme odhadnout pomocí spektrochemické řady ligandů, což je výčet ligandů seřazený podle síly generovaného pole:
S2- < SCN– < Cl– < F– < OH– < H2O < NH3 < CN– < CO
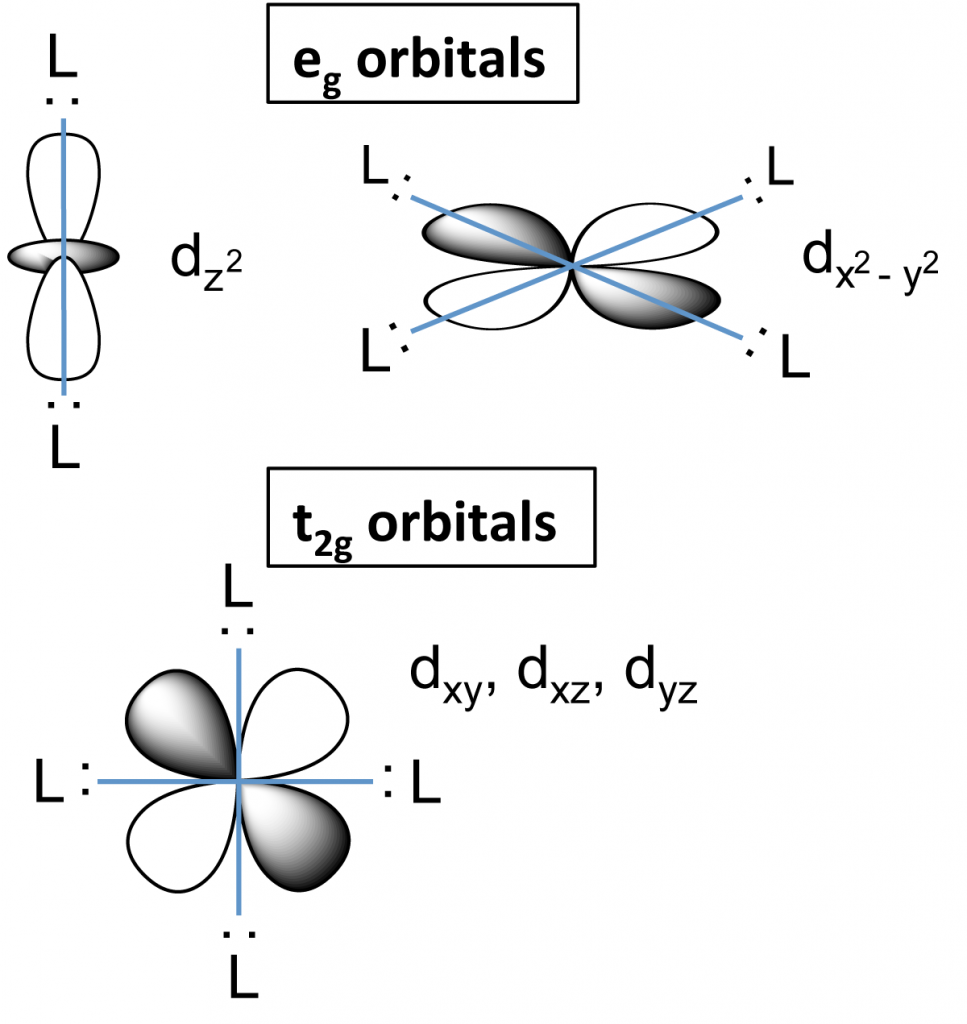
Malá vsuvka – d-orbitaly
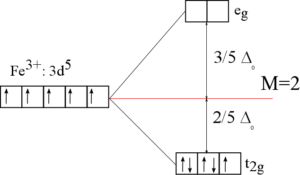
Existuje pět d-orbitalů, podle symetrie je můžeme rozdělit na dvě skupiny: t2g – sem patří tři orbitaly, jejichž laloky leží mezi osami souřadného systému, tj. dxy, dyz a dxz a eg – dva orbitaly, jejichž laloky leží v osách souřadného systému, tj. dz2 a dx2-y2.
Teorie ligandového pole (LFT)
Teorie ligandového pole vznikla jako kombinace CFT a teorie molekulových orbitalů. V roce 1957 ji formulovali Griffith a Orgel.[4] Teorie využívá elektrostatické interakce pro popis chování kovových iontů v roztoku a molekulových orbitalů pro popis rozdílů v interakcích mezi ligandy a kovem.
Multiplicita
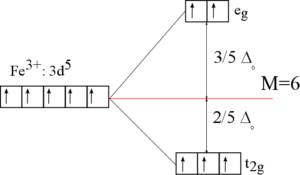
Počet nepárových elektronů popisuje veličina multiplicita (M), která je dána vztahem:
M = 2S + 1
S je celkový spin komplexu (viz tabulka).
| Počet nespárovaných elektronů | S | M | Označení |
|---|---|---|---|
| 0 | 0 | 1 | Singlet |
| 1 | 1/2 | 2 | Dublet |
| 2 | 1 | 3 | Triplet |
| 3 | 3/2 | 4 | Kvartet |
| 4 | 2 | 5 | Kvintet |
| 5 | 5/2 | 6 | Sextet |
| 6 | 3 | 7 | Septet |
Štěpení v okteadrickém poli
Komplex se skládá z centrálního atomu a šesti ligandů, které jsou umístěny ve vrcholech oktaedru (všechny úhly LML=90° a všechny vazebné délky L-M stejné). Orbitaly eg si zvýší energii oproti neštěpeným d-orbitalům a orbitaly t2g si ji naopak sníží. Rozdíl mezi energetickými hladinami označujeme jako stabilizační energii oktaedrického pole (ΔO). V případě silných ligandů je hodnota ΔO vyšší než hodnota párovací energie v d-orbitalech, proto se nejprve zcela zaplní orbitaly t2g a až poté se začnou plnit orbitaly eg, vznikají tzv. nízkospinové komplexy.
Pokud jsou v komplexu slabé ligandy, je energie štěpení menší než párovací energie v d-orbitalech, pak je pro elektrony výhodnější nejprve zpola zaplnit všech pět orbitalů a až poté doplňovat elektronové páry v orbitalech.
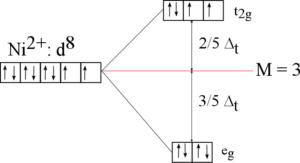
Štěpení v tetraedrickém poli
Komplex se skládá z centrálního atomu a čtyř ligandů, které jsou umístěny ve vrcholech tetraedru (všechny úhly LML=109,5° a všechny vazebné délky L-M stejné). Štěpení orbitalů je opačné, eg jdou energeticky dolů a t2g nahoru. Síla tetraedrického pole (Δt) je menší než polovina oktaedrického pole (přesně jde o 4/9ΔO), proto jsou všechny tetraedrické komplexy vysokospinové.
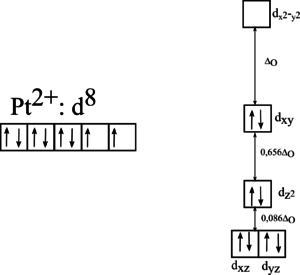
Štěpení ve čtvercovém poli
Čtvercové komplexy mají všechny čtyři ligandy umístěné v rovině xy, tzn. že orbitaly ležící v této rovině, budou s ligandy interagovat a tím dojde ke zvýšení jejich energie. Získáme celkem čtyři energetické hladiny, vzhledem k velikosti štěpení jsou čtvercové komplexy téměř vždy nízkospinové. Příkladem může být cis-platina [PtCl2(NH3)2], jejiž štěpení je na obrázku dole.
Se čtvercovou geometrií se setkáváme u iontů s konfigurací d8, např. Pt2+ nebo Pd2+.
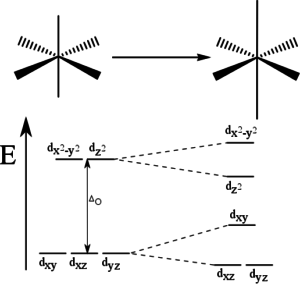
Jahnův–Tellerův efekt
Teorém postulovali v roce 1937 Hermann Arthur Jahn a Edward Teller.
- Jahnův–Tellerův teorém
- Každá nelineární molekula, která má elektrony v degenerovaném stavu, bude nestálá a bude se deformovat tak, aby vznikl systém o nižší energii, v němž bude degenerace odstraněna.
S tímto jevem se můžeme setkat např. u oktaedrických komplexů iontů d4 a d9, např. u CuF2, který je tvořen oktaedrickými jednotkami CuF6.[6] V tomto oktaedrickém komplexu jsou d-orbitaly rozštěpeny na dvě sady, t2g a eg (viz výše), vlivem tohoto efektu dojde k dalšímu štěpení d-orbitalů a tím, k jejich energetické stabilizaci. U oktaedrických komplexů může dojít buď k jejich protažení (tzn, že axiální vazby budou delší než ekvatoriální), nebo ke zkrácení (axiální vazby budou kratší než ekvatoriální). V případě protažení axiálních vazeb (ležících v ose z), dojde ke snížení energie d-orbitalů s komponentou z (dxz, dyz a dz2), zbylé orbitaly si energii zvýší. V případě zkrácení to bude naopak.
Trans efekt
Trans efekt je schopnost ligandu usnadňovat substituci v poloze trans. Nejvíce byl studován na čtvercových komplexech PtII. Ligandy můžeme seřadit do posloupnosti:
F–, OH–, H2O, NH3, py < Cl– < Br– < I–, SCN–, NO2–, C6H5– < S=C(NH2)2, CH3– < H–, PR3 < CN–, CO, C2H4
Trans efekt lze demonstrovat dvojicí substitučních reakcí, kde se projeví silnější vliv chloridu oproti NH3 ligandu.
Trans efekt je důležitým faktorem pro plánování syntéz komplexních sloučenin, např. cisplatiny.
Literatura
- Hapticita v IUPAC Gold Book
- GREENWOOD, N. N. a Alan EARNSHAW. Chemie prvků. Praha: Informatorium, 1993. ISBN 80-85427-38-9.
- SCHWARZENBACH, G. Der Chelateffekt. Helvetica Chimica Acta [online]. 1952, 35(7), 2344-2359 [cit. 2017-02-19]. DOI: 10.1002/hlca.19520350721. ISSN 0018-019x. Dostupné z: http://doi.wiley.com/10.1002/hlca.19520350721
- GRIFFITH, J.S., ORGEL, L.E. Ligand Field Theory. Q. Rev. Chem. [online]. 1957, 11, 381-383 [cit. 2017-02-24]. DOI: 10.1039/QR9571100381. Dostupné z: http://pubs.rsc.org/en/content/articlelanding/1957/qr/qr9571100381
- HOUSECROFT, Catherine E. a A. G. SHARPE. Anorganická chemie. Praha: Vysoká škola chemicko-technologická v Praze, 2014. ISBN 978-80-7080-872-6.
- Billy, C.; Haendler, H. A. J. Am. Chem. Soc., 1957, 79, 1049–1051. DOI: 10.1021/ja01562a011
Další kapitoly
- České chemické názvosloví
- Platné číslice a měření
- Základní chemické zákony
- Důležité veličiny a vztahy v chemii
- Výpočet stechiometrického vzorce
- Chemické rovnice a stechiometrické výpočty
- Koncentrace roztoků
- Rozpustnost, součin rozpustnosti
- Stavba atomu
- Periodická tabulka prvků a periodicita vlastností
- Chemická vazba
- VSEPR
- Komplexní sloučeniny
- Magnetické vlastnosti látek
- Termodynamika
- Chemická rovnováha
- Skupenské stavy látek
- Fázové rovnováhy
- Teorie kyselin a zásad
- pH, aktivita roztoku
- Elektrochemie
- Symetrie molekul
- Laboratorní technika
- Lineární regrese
- Jednotky tlaku
- Jednotky teploty
- Mohsova stupnice tvrdosti minerálů
- Odkazy
- Prezentace k semináři z obecné chemie