Jde o metodu odměrné analýzy založenou na neutralizačních reakcích, tzn. na reakci mezi kyselinou a zásadou. Pro monitorování průběhu je důležité sledování hodnoty pH roztoku.
Setkáváme se čtyřmi základními typy reakcí:
- Reakce silné kyseliny se silnou zásadou
- Reakce silné kyseliny se slabou zásadou
- Reakce slabé kyseliny se silnou zásadou
- Reakce slabé kyseliny se slabou zásadou
Nejvýhodnější je samozřejmě první typ reakce. Jako příklad může sloužit stanovení koncentrace roztoku NaOH, zde jako odměrný roztok použijeme roztok HCl a jako indikátor fenolftalein, který je v zásaditém pH fialový a po překročení bodu ekvivalence dojde k odbarvení. V průběhu titrace probíhá jednoduchá neutralizační reakce:
NaOH + HCl → NaCl + H2O
Vzhledem k tomu, že jsou všechny stechiometrické koeficienty v rovnici rovny jedné, odpovídá látkové množství HCl látkovému množství NaOH. Pokud bychom použili kyselinu sírovou, bylo by látkové množství NaOH dvojnásobné:
2 NaOH + H2SO4 → Na2SO4 + 2 H2O
Jako standard pro zjištění přesné koncentrace odměrného roztoku se používá např. hydrogenuhličitan draselný nebo šťavelan sodný:
KHCO3 + HCl → KCl + CO2 + H2O
Indikátory
Acidobazické indikátory jsou látky, jejichž barva se mění v závislosti na pH prostředí. Známe jich poměrně velké množství, nejpoužívanější jsou:
| Indikátor | pH barevného přechodu | Barva v kyselém prostředí | Barva v zásaditém prostředí |
| Thymolová modř | 1,2–2,8 | červená | žlutá |
| Methyloranž | 3,1–4,5 | červená | žlutá |
| Methylčerveň | 4,4–6,3 | červená | žlutá |
| Bromthymolová modř | 6,0–7,6 | žlutá | modrá |
| Fenolftalein | 8,2–10,0 | bezbarvá | fialová |
| Thymolftalein | 9,3–10,5 | bezbarvá | modrá |
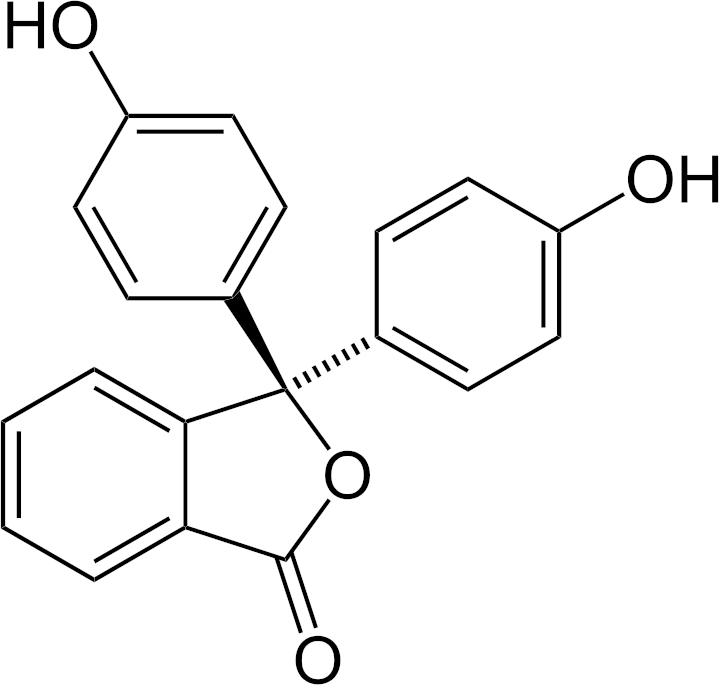
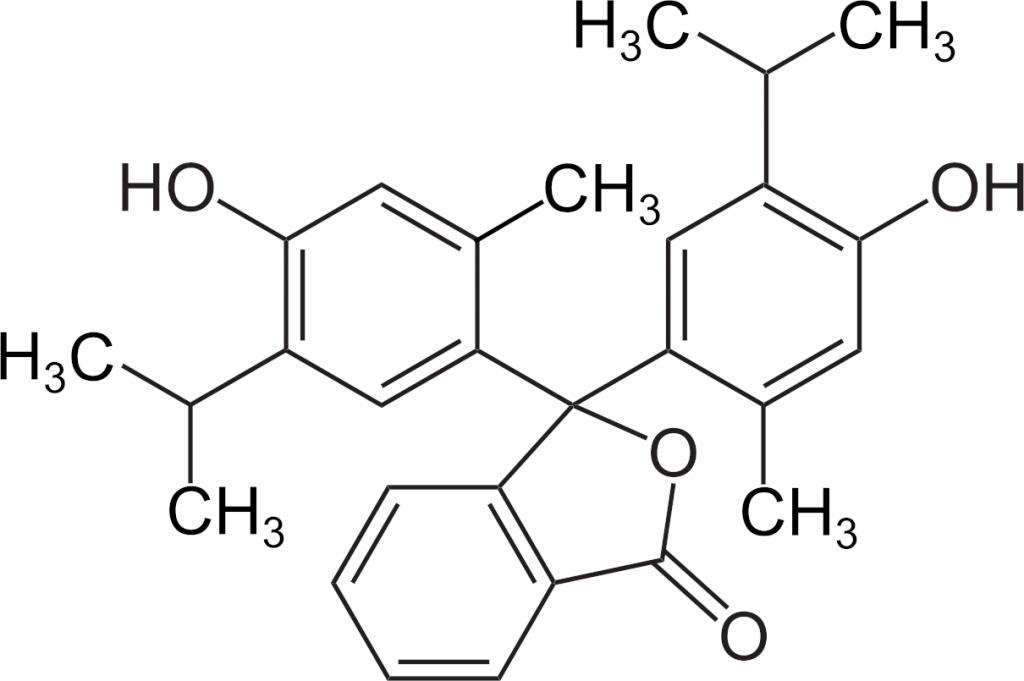
Indikátor volíme podle pH, ve kterém nastává bod ekvivalence. Použití indikátorů sebou nese chybu, kterou nejsme schopni eliminovat, barevný přechod totiž nastává až za bodem ekvivalence. Výrazně přesnější je titrace s využitím skleněné elektrody, pomocí které měříme přímo pH, resp. změny pH v průběhu titrace.
Titrační křivka
Titrační křivka je závislost hodnoty pH na objemu přidaného odměrného činidla. Pokud titrujeme roztok HCl roztokem NaOH, začíná titrace v kyselé oblasti, ekvivalence nastává při pH 7 a dále už jen přidáváme NaOH do roztoku NaCl, takže pH narůstá.
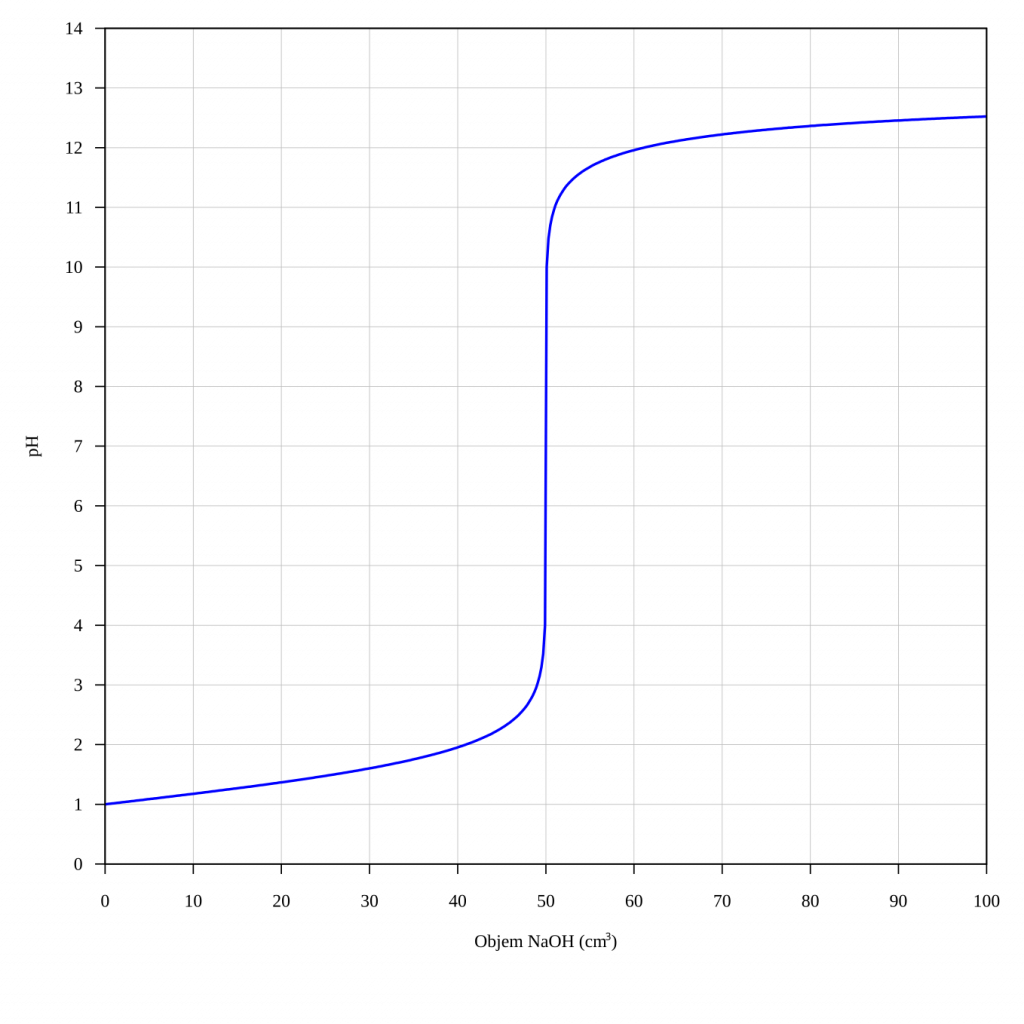
Výpočet
Jako příklad můžeme vzít titraci roztoku hydroxidu sodného odměrným roztokem kyseliny sírové. Koncentrace kyseliny byla 0,5 M, faktor roztoku 0,9856. Titrovali jsme 20 cm3 roztoku NaOH připraveného rozpuštěním navážky 2,5132 g NaOH v odměrné baňce o objemu 100 cm3. Průměrná spotřeba byla 10,85 cm3.
Nejprve napíšeme rovnici titrace:
2 NaOH + H2SO4 → Na2SO4 + 2 H2O
Pro výpočet budeme potřebovat přesnou molární koncentraci odměrného roztoku, tu získáme součinem koncentrace a faktoru roztoku:
c = 0,5 * 0,9856 = 0,4928 M
Látkové množství H2SO4 zjistíme ze vztahu pro molární koncentraci:
n = c * V = 0,4928 * 0,01085 = 0,0053 mol
Z chemické rovnice vyplývá, že látkové množství NaOH bude dvojnásobné:
n = 2 * c * V = 2 * 0,4928 * 0,01085 = 0,0107 mol
Ze 100 cm3 odměrného roztoku jsme titrovali pouze 20 cm3, proto je látkové množství NaOH v titrační baňce rovno pětinásobku této hodnoty:
n = fz * f * c * V = 5 * 2 * 0,4928 * 0,01085 = 0,0535 mol
Člen fz se označuje jako zřeďovací faktor a je roven poměru titrovaného objemu a objemu odměrné baňky.
Hmotnost NaOH zjistíme ze vztahu pro látkové množství:
m = n * M = 0,0535 * 40 = 2,14 g
Navážka 2,5132 g vzorku obsahovala 2,1400 g NaOH, tzn. čistota vzorku byla:
$$\textrm{w} = \frac{\textrm{m}}{\textrm{m}_\textrm{c}} = \frac{2,14}{2,5132} = 0,85$$
Vzorek obsahoval 85 % NaOH.
Další kapitoly
- České chemické názvosloví
- Platné číslice a měření
- Základní chemické zákony
- Důležité veličiny a vztahy v chemii
- Výpočet stechiometrického vzorce
- Chemické rovnice a stechiometrické výpočty
- Koncentrace roztoků
- Rozpustnost, součin rozpustnosti
- Stavba atomu
- Periodická tabulka prvků a periodicita vlastností
- Chemická vazba
- VSEPR
- Komplexní sloučeniny
- Magnetické vlastnosti látek
- Termodynamika
- Chemická rovnováha
- Skupenské stavy látek
- Fázové rovnováhy
- Teorie kyselin a zásad
- pH, aktivita roztoku
- Elektrochemie
- Symetrie molekul
- Laboratorní technika
- Lineární regrese
- Jednotky tlaku
- Jednotky teploty
- Mohsova stupnice tvrdosti minerálů
- Odkazy
- Prezentace k semináři z obecné chemie