Rozpustnost je velice důležitá veličina, vyjadřující maximální množství látky, které se v daném rozpouštědla, za dané teploty rozpustí. Většinou se označuje písmenem s a jednotkou je g/100 g rozpouštědla. Např. rozpustnost NaCl ve vodě, při 30 °C je 38,89 g/100 g H2O (ve 100 g vody se při 30 °C rozpustí maximálně 38,89 g chloridu sodného). Podle hodnoty rozpustnosti rozlišujeme látky rozpustné a nerozpustné (rozpustnost pod 0,1 g/100 g).
Rozpouštění látek je poměrně komplikovaný proces, pro běžnou praxi je vhodné si zapamatovat pravidlo: „Podobné se rozpouští v podobném“,
což znamená, že polární látka bude pravděpodobně rozpustná v polárním rozpouštědle (např. sůl ve vodě) a nepolární v nepolárním rozpouštědle (např. tuky v hexanu).
| Látka | Rozpouštědlo | Rozpustnost [g/100 g] |
|---|---|---|
| NaCl | Voda | 38,89 |
| Hexan | Voda | 0,0112 |
| Hexan | Heptanol | ∞ |
Řešené příklady na téma rozpustnost.
Mechanismus rozpouštění pevné látky v kapalném rozpouštědle
Prvním krokem je postupné odtrhávání molekul rozpouštěné látky z povrchu. Tento děj je zpravidla endothermní, protože je nutné překonat mřížkovou energii (u krystalických látek), entropie během tohoto procesu narůstá (ΔS>0). V druhém kroku dochází k solvataci uvolněných molekul, tzn. jejich obalení molekulami rozpouštědla. Tento krok je obvykle exothermní a entropie opět narůstá. Konečné rozpouštěcí teplo (enthalpie) je rovno součtu enthalpií jednotlivých kroků procesu.
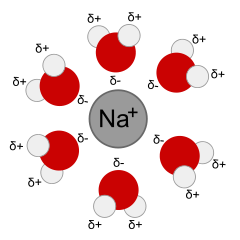
Rozpustnost látky je ovlivněna mnoha faktory, nejdůležitější jsou:
- druh rozpouštědla
- teplota
- tlak (při rozpouštění plynů)
- přítomnost dalších látek v roztoku
Disociace elektrolytů
Jako elektrolyty označujeme roztoky nebo taveniny, které vedou elektrický proud. Nejčastěji vznikají rozpouštěním iontových látek v polárních rozpouštědlech (nejčastěji ve vodě).
Pravé elektrolyty jsou iontové i v pevném stavu, např. NaCl.
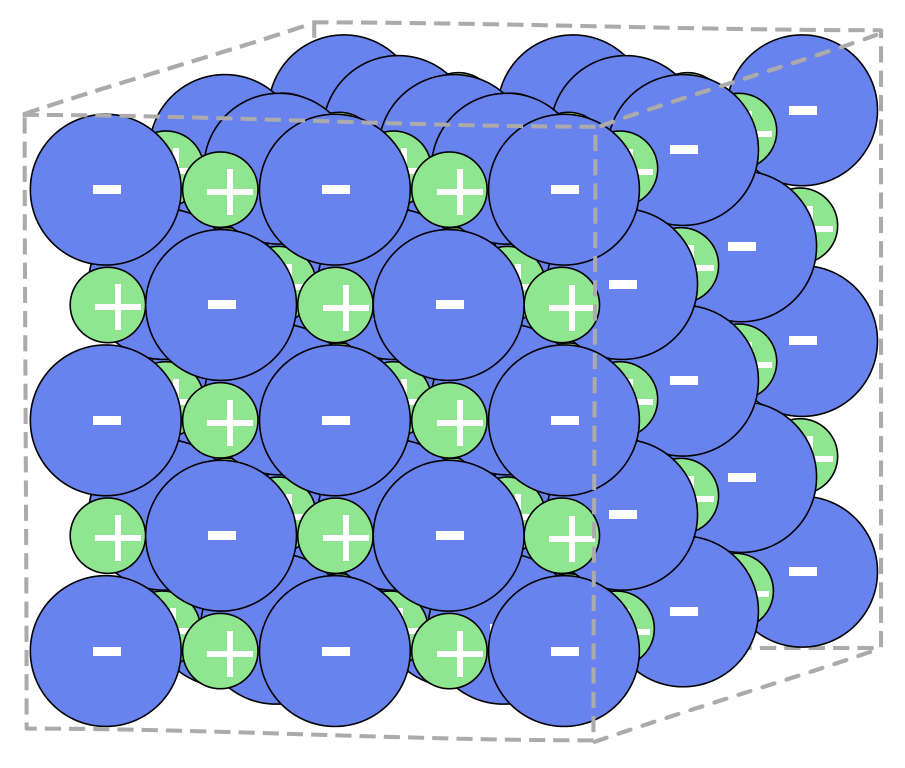
Potencionální elektrolyty obsahují kovalentní vazby, ionty vznikají až při rozpouštění v polárních rozpouštědlech. Jde např. o HCl nebo H2SO4.
Podle stupně disociace rozlišujeme slabé a silné elektrolyty. Silné elektrolyty, např. NaCl, disociují zcela, naproti tomu slabé elektrolyty, např. HClO jsou disociované pouze z části.
NaCl → Na+ + Cl–
HClO ⇄ H+ + ClO–
Disociační konstanta je dána poměrem rovnovážných koncentrací produktů a výchozích látek:
$$K_d = \frac{[\textrm{H}^+][\textrm{ClO}^-]}{[\textrm{HClO}]}$$
Stupeň disociace (α)
$$\alpha = \frac{\textrm{n}_{\textrm{disoc}}}{\textrm{n}_0}$$
Ostwaldův zřeďovací zákon
Popisuje vztah mezi disociační konstantou a stupněm disociace slabého elektrolytu. Byl formulován Wilhelmem Ostwaldem.
$$K_d = \frac{[\textrm{H}^+][\textrm{ClO}^-]}{[\textrm{HClO}]} = \frac{\alpha^2}{1-\alpha}.\textrm{c}_\textrm{0}$$
$$\alpha^2 = \frac{K_d}{\textrm{c}_\textrm{0}}$$
$$\alpha = \sqrt{\frac{K_d}{\textrm{c}_\textrm{0}}}$$
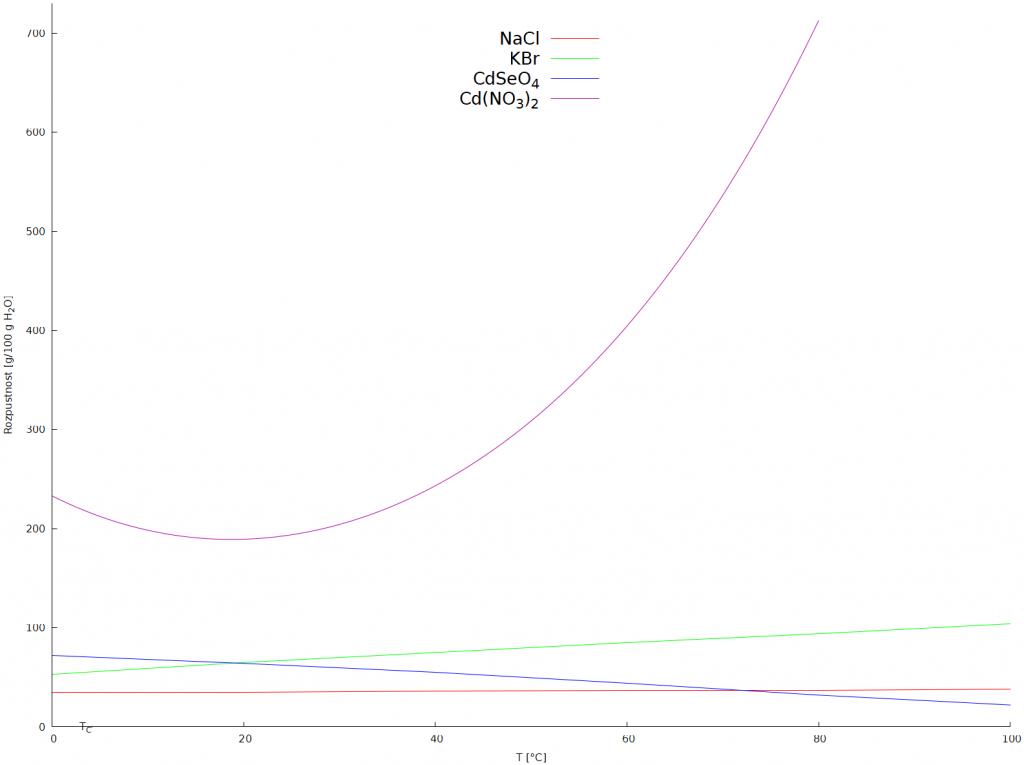
Závislost rozpustnosti na teplotě
U většiny látek rozpustnost stoupá s rostoucí teplotou, menší množství sloučenin vykazuje opačný trend. Známe i látky, např. NaCl, u nichž se rozpustnost s teplotou prakticky nemění. Rozdílné závislosti rozpustnosti na teplotě se využívá při izolaci sloučenin pomocí frakční krystalizace.
Součin rozpustnosti
Pro nerozpustné, resp. velmi málo rozpustné látky jsou hodnoty rozpustnosti velmi malé, proto se používá praktičtější veličina – součin rozpustnosti. Značí se Ks, často se používá i jeho logaritmická forma pKs.
pKs = −log Ks
Odvozuje se ze vzorce pro rovnovážnou konstantu rozpouštění, ukážeme si to na příkladu rozpouštění sulfidu stříbrného (Ag2S).
Ag2S ⇄ 2 Ag+ + S2-

Rovnováha je samozřejmě posunuta směrem k nerozpuštěnému sulfidu. Rovnovážná konstanta je dána poměrem rovnovážných aktivit, nebo jednodušeji rovnovážných koncentrací:
$$K_s = \frac{[\textrm{Ag}^+]^2[\textrm{S}^{2-}]}{[\textrm{Ag}_2\textrm{S}]}$$
Pro pevnou fázi je hodnota aktivity rovna jedné, proto se vztah zjednoduší na:
Ks = [Ag+]2 [S2-]
Hodnota součinu rozpustnosti Ag2S je pKs = 49,20. Z toho lze snadno vypočítat koncentraci iontů v nasyceném vodném roztoku Ag2S:
Ks = 10-49,20 = 6,3.10-50
Jelikož víme, že koncentrace Ag+ bude dvojnásobná (2x) oproti S2- (x):
Ks = [Ag+]2 [S2-] = (2x)2x = 4x3
x = 2,51.10-17 mol.dm-3
Z hodnoty koncentrace vyplývá, že zůstane rozpuštěna jen velmi malá část sulfidu. Pokud bychom chtěli rozpustnost ještě snížit, je možné zvýšit koncentraci sulfidových aniontů přídavkem rozpustného sulfidu, např. nastavíme koncentraci S2- na 0,1 mol.dm-3, tím se nám vztah pro Ks změní:
Ks = [Ag+]2 [S2-] = (2x)2 . 0,1
x = 3,97.10-25 mol.dm-3
Rozpustnost Ag2S se přídavkem rozpustného sulfidu snížila o osm řádů, tato operace se nazývá vysolování.
Video – součin rozpustnosti
Video demonstruje součin rozpustnosti pomocí argentometrické titrace. Bližší vysvětlení najdete zde.
Příklady
Další příklady najdete zde.
Další kapitoly
- České chemické názvosloví
- Platné číslice a měření
- Základní chemické zákony
- Důležité veličiny a vztahy v chemii
- Výpočet stechiometrického vzorce
- Chemické rovnice a stechiometrické výpočty
- Koncentrace roztoků
- Rozpustnost, součin rozpustnosti
- Stavba atomu
- Periodická tabulka prvků a periodicita vlastností
- Chemická vazba
- VSEPR
- Komplexní sloučeniny
- Magnetické vlastnosti látek
- Termodynamika
- Chemická rovnováha
- Skupenské stavy látek
- Fázové rovnováhy
- Teorie kyselin a zásad
- pH, aktivita roztoku
- Elektrochemie
- Symetrie molekul
- Laboratorní technika
- Lineární regrese
- Jednotky tlaku
- Jednotky teploty
- Mohsova stupnice tvrdosti minerálů
- Odkazy
- Prezentace k semináři z obecné chemie