Ideální plyn je zjednodušeným modelem reálného plynu. Umožňuje poměrně snadno určit chování plynu nebo směsi plynů. Pro chování ideálního plynu platí následující pravidla:
- Částice plynu považujeme za hmotné body, které nemají svůj objem. Plyn lze tedy stlačit na nulový objem.
- Částice spolu neinteragují, pouze se srážejí.
- Při srážkách se částice plynu chovají jako dokonale pružná tělesa, nedochází tedy k výměně energie mezi částicemi.
1 mol ideálního plynu při teplotě 25 °C a tlaku 101,325 kPa zaujímá objem 22,414 dm3 (molární objem, Vm).
$$n=\frac{V}{V_m}$$Stavová rovnice ideálního plynu
Stavová rovnice popisuje vztah mezi tlakem, objemem a teplotou plynu.
$$pV = nRT = \frac{m}{MRT}$$ $$\rho = \frac{pM}{RT}$$ $$M = \frac{\rho RT}{p} = \frac{RT}{V_m}$$R = 8,314 4621(75) J.K-1.mol-1; molární plynová konstanta
Pro změny stavu plynu platí:
$$\frac{p_1V_1}{n_1T_1} = \frac{p_2V_2}{n_2T_2}$$Molární objem
Ze stavové rovnice můžeme vypočítat molární objem. Jeho hodnota pochopitelně závisí na teplotě a tlaku, při 0 °C a tlaku 101 325 Pa je molární objem:
$$V_m = \frac{nRT}{p} = \frac{1\ .\ 8,314\ .\ 273,15}{101\ 325} = 22,414\ dm^3.mol^{-1}$$
Při tlaku 100 kPa, který je IUPACem stanovený jako standardní tlak je pak molární objem 22,711 dm3.mol-1.
$$V_m = \frac{nRT}{p} = \frac{1\ .\ 8,314\ .\ 273,15}{100\ 000} = 22,711\ dm^3.mol^{-1}$$
Standardní podmínky pro plyny
IUPAC definuje standardní podmínky pro plyny jako 0 °C a 100 kPa. Dříve používaný tlak 101 325 Pa (1 atmosféra) už není doporučovaný.
Boyleův zákon
Součin tlaku a objemu plynu je za izotermických podmínek konstantní. Pokud dojde ke zvýšení tlaku, musí se úměrně zmenšit objem a naopak.
p.V = konst.
p1.V1 = p2.V2
Daltonův zákon
Celkový tlak směsi plynů je roven součtu parciálních tlaků všech složek směsi.
$$p_{celk} = \displaystyle\sum_{i=0}^{n} p_i$$Parciální tlak
Tlak komponenty ve směsi. Složky směsi ideálních plynů se v nádobě chovají, jako by tam byly samy.
Molární zlomek
$$X_i = \frac{n_i}{\sum n}$$Parciální tlak plynu ve směsi vypočítáme jako součin celkového tlaku v systému a molárního zlomku plynu:
$$p_i\ =\ p\ .\ X_i$$
Děje v plynech
Pokud během děje dochází ke změně všech tří stavových veličin (p, V, T) počítáme se stavovou rovnicí, jak je uvedeno výše. Pokud je jedna z veličin konstantní, můžeme si výpočet zjednodušit.
Izochorický děj
Objem plynu je během děje konstantní. Ze stavové rovnice ideálního plynu vyplývá, že:
$$p = konst . T$$
$$\frac{p}{T} = konst.$$
$$\frac{p_1}{T_1} = \frac{p_2}{T_2}$$
Tlak plynu je tedy přímo úměrný teplotě plynu.
Příkladem izochorického děje je např. ohřev vzduchu v pneumatice při jízdě. Pokud je při teplotě 20 °C tlak v pneumatice 200 kPa, můžeme snad spočítat tlak při teplotě 60 °C, což odpovídá pneumatice zahřáté jízdou v horkém létě.
$$p_2 = \frac{p_1 . T_2}{T_1} = \frac{200 000 . 333,15}{293,15} = 227 290 Pa$$
Tlak tedy během jízdy vzroste přibližně na 227 kPa, čili o více než 14 %.
Izobarický děj
Tlak je během děje konstantní. Ze stavové rovnice ideálního plynu vyplývá, že:
$$V = konst . T$$
$$\frac{V}{T} = konst.$$
$$\frac{V_1}{T_1} = \frac{V_2}{T_2}$$
Objem plynu je tedy přímo úměrný teplotě plynu.
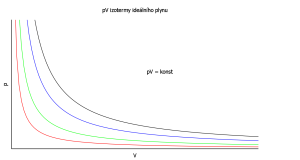
Izotermický děj
Teplota je během děje konstantní. Ze stavové rovnice ideálního plynu vyplývá, že:
$$p.V = konst.$$
$$p_1.V_1 = p_2.V_2$$
Součin tlaku a objemu je za konstantní teploty během všech pochodů konstantní (viz Boyleův zákon).
Reálný plyn
Chování reálného plynu popisuje van der Waalsova stavová rovnice:
$$(p+\frac{an^2}{V^2})(V – nb) = nRT$$
Konstanty a a b najdeme v tabulkách. Člen \(\frac{an^2}{V^2}\) je korekce na interakce molekul a člen nb je korekce na vlastní objem částic.
| Plyn | a \([\frac{m^2 Pa}{mol^2}]\) | b \([10^{-6} \frac{m^3}{mol}]\) |
|---|---|---|
| Chlor (Cl2) | 0,658 | 56,2 |
| Helium (He) | 0,0035 | 34,1 |
| Krypton (Kr) | 0,235 | 39,8 |
| Kyslík (O2) | 0,138 | 31,8 |
| Methan (CH4) | 0,228 | 42,8 |
| Vodík (H2) | 0,0247 | 26,6 |
Další příklady najdete zde.
Další kapitoly
- České chemické názvosloví
- Platné číslice a měření
- Základní chemické zákony
- Důležité veličiny a vztahy v chemii
- Výpočet stechiometrického vzorce
- Chemické rovnice a stechiometrické výpočty
- Koncentrace roztoků
- Rozpustnost, součin rozpustnosti
- Stavba atomu
- Periodická tabulka prvků a periodicita vlastností
- Chemická vazba
- VSEPR
- Komplexní sloučeniny
- Magnetické vlastnosti látek
- Termodynamika
- Chemická rovnováha
- Skupenské stavy látek
- Fázové rovnováhy
- Teorie kyselin a zásad
- pH, aktivita roztoku
- Elektrochemie
- Symetrie molekul
- Laboratorní technika
- Lineární regrese
- Jednotky tlaku
- Jednotky teploty
- Mohsova stupnice tvrdosti minerálů
- Odkazy
- Prezentace k semináři z obecné chemie