Termodynamika se zabývá procesy a vlastnostmi látek spojenými s teplem a teplotními přeměnami. Nezabývá se mechanismem ani rychlostí přeměny, umožňuje předpovědět směr reakce a její samovolnost a rozsah.
Důležité pojmy
- Extenzivní veličiny – závisí na příspěvcích od jednotlivých částí soustavy, jsou aditivní – hmotnost, elektrický náboj, látkové množství, …
- Intenzivní veličiny – nejsou aditivní – teplota, tlak, viskozita, koncentrace, hustota, …
- Stav systému – je popsán intenzivními veličinami (T, p, c)
- Stavová funkce – fyzikální charakteristika, jejíž hodnota závisí na stavu soustavy
- Izolovaný systém – nevyměňuje s okolím ani energii, ani hmotu
- Uzavřený systém – vyměňuje s okolím energii, ale ne hmotu
- Otevřený systém – vyměňuje s okolím energii i hmotu
- Teplota – pravděpodobnostní veličina, popisuje makroskopické systémy
- Teplo – část vnitřní energie
Termodynamické zákony
Nultý
- Jsou-li dvě a více těles v termodynamické rovnováze s tělesem dalším, pak jsou všechna tato tělesa v rovnováze
První
- Celkové množství energie (všech druhů) izolované soustavy zůstává zachováno
Druhý
- Teplo nemůže při styku dvou těles různých teplot samovolně přecházet z tělesa chladnějšího na těleso teplejší
- Nelze sestrojit periodicky pracující tepelný stroj, který by trvale konal práci pouze tím, že by ochlazoval jedno těleso, a k žádné další změně v okolí by nedocházelo
Třetí (Nernstův teorém)
- Čistou pevnou látku nelze konečným pochodem ochladit na teplotu absolutní nuly (0 K; -273,15 °C), k této teplotě se lze pouze přiblížit
- V roce 2017 byl třetí TD zákon odvozen a dokázán pomocí ostatních zákonů TD.
Vnitřní energie U
Stavová veličina – závisí na stavu systému, ale ne na tom, jak se systém do tohoto stavu dostal. Vnitřní energie je součet energie všech částic, které systém obsahuje. Lze ji také definovat jako součet kinetické a potenciální energie systému.
$$U = \sum_{i=0}^n \frac{1}{2}m_i v_i^2 + E_p$$
Její absolutní hodnotu nelze ani vypočítat, ani změřit, pouze její změny.
ΔU = ΔU2 – ΔU1
Ke změně vynitřní energie může dojít dvěma způsoby:
- Konáním práce – stlačováním nebo expanzí plynu, třením těles, apod.
- Tepelnou výměnou – ohřevem nebo ochlazením tělesa
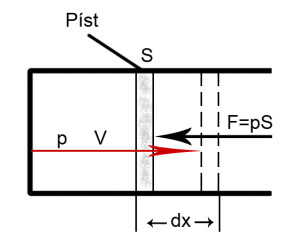
Objemová práce W
Práce, kterou systém vykonal nebo spotřeboval.
W = Fdx = pAdx = pdV
dV = SdX; S – plocha pístu
Pokud systém koná práci je W < 0; pokud ji přijímá je práce kladná.
Entalpie a entropie
Entalpie (H) vyjadřuje množství energie uložené v systému.
ΔH = ΔU + pΔV
Za izobarických podmínek je entalpie rovna množství tepelné energie (Q) v systému.
ΔH = Q
dH(S,p) = TdS + Vdp
Entropie (S) popisuje neuspořádanost systému, resp. počet stavů, které může systém nabýt. Pi označuje pravděpodobnost i-tého stavu.
$$S = -k\sum_i P_i \ln P_i$$
ΔS > 0 – spontánní proces
ΔS < 0 – proces probíhá v opačném směru
ΔS = 0 – rovnováha
Termochemie
Věda studující tepelné zabarvení reakcí.
Reakční teplo reakce a reakční teplo opačné reakce jsou až na znaménko stejná. Výsledná hodnota reakčního tepla nezávisí na průběhu chemické reakce, ale pouze na počátečním a konečném stavu.
- ΔH > 0 – endotermní reakce
- ΔH < 0 – exotermní reakce
- ΔH = 0 – atermická reakce
Pro správný výpočet reakčního tepla je nutné znát skupenství všech látek v reakci.
CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(g) ΔH = -802 kJ
CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(l) ΔH = -890 kJ
Standardní spalné teplo – teplo, při kterém se spálí 1 mol látky v nadbytku kyslíku. Spalná tepla prvků jsou nenulová.
$$\Delta H_{298}^0 = \sum(\Delta H_{sp}^0)_{reakt} – \sum(\Delta H_{sp}^0)_{prod} \\
\Delta H_{298}^0 = \sum(\Delta H_{sl}^0)_{prod} – \sum(\Delta H_{sl}^0)_{reakt}$$
Standardní slučovací teplo – teplo, při kterém vzniká 1 mol látky přímo z prvků, reakční látky musí být ve standardním stavu. Standardní slučovací tepla prvků jsou rovna nule.
Gibbsova energie G
Stavová funkce, jde o kritérium samovolnosti děje za izobaricko-izotermických podmínek.
ΔG0 – Gibbsova volná energie za standardních podmínek
- 298,15 K (25 °C)
- 100 000 Pa (1 bar) pro plyny
- Koncentrace roztoků 1 M
Hodnoty ΔG0 jsou tabelovány.
$$\Delta G^0 = \Delta H^0 – T \Delta S^0 \\
\Delta G^0_{reak} = \sum\nu_{prod}\Delta G^0_{sluc}(prod)\ – \sum\nu_{reakt}\Delta G^0_{sluc}(reakt)$$
ν – stechiometrický koeficient
Další kapitoly
- České chemické názvosloví
- Platné číslice a měření
- Základní chemické zákony
- Důležité veličiny a vztahy v chemii
- Výpočet stechiometrického vzorce
- Chemické rovnice a stechiometrické výpočty
- Koncentrace roztoků
- Rozpustnost, součin rozpustnosti
- Stavba atomu
- Periodická tabulka prvků a periodicita vlastností
- Chemická vazba
- VSEPR
- Komplexní sloučeniny
- Magnetické vlastnosti látek
- Termodynamika
- Chemická rovnováha
- Skupenské stavy látek
- Fázové rovnováhy
- Teorie kyselin a zásad
- pH, aktivita roztoku
- Elektrochemie
- Symetrie molekul
- Laboratorní technika
- Lineární regrese
- Jednotky tlaku
- Jednotky teploty
- Mohsova stupnice tvrdosti minerálů
- Odkazy
- Prezentace k semináři z obecné chemie
One Reply to “Termodynamika”