Vlastnosti elektronů a iontů v pevných látkách jsou určovány především vzájemným působení atomů vytvářejících pevnou látku. Vazební síly v krystalu jsou určeny chemickou vazbou, která se tak stává určujícím činitelem pro elektrické, tepelné, magnetické a další vlastnosti látky. Kvantová teorie chemické vazby vychází z předpokladu, že atomy vytvářejí molekuly, nebo krystaly jen tehdy, zmenšuje-li se při jejich vzniku celková energie soustavy. Chemické vazby se účastní elektrony valenční sféry jednotlivých atomů. Při jejich dostatečně těsném přiblížení dochází ke vzájemné interakci. Podle druhu vzájemné interakce valenčních elektronů vzniká chemická vazba, jejíž charakter a velikost určuje rozložení atomů v prostoru i charakteristické vlastnosti materiálu. Tyto vztahy názorně vyjadřuje následující zjednodušené schéma.
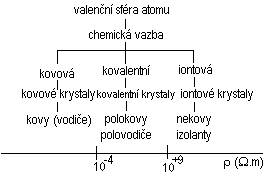
Schéma zjednodušuje situaci, neboť pro složitější strukturu valenční sféry elektronového obalu vznikají složené vazby, které podstatněji komplikují strukturu materiálů i jejich vlastnosti.
Prvky, které mají ve valenční sféře atomového obalu malý počet elektronů se vyznačují tím, že tyto elektrony jsou slabě vázány k jádru atomu. Sblíží-li se atomy uvažovaného prvku na dostatečně krátkou vzdálenost (desetiny nanometru), takže se energeticky dostupné orbitaly začnou překrývat, dojde ke sdílení valenčních elektronů mezi atomy. V tomto případě nevzniká směrová vazba, takže sdílené elektrony se mohou více méně volně pohybovat mezi kladně nabitými ionty atomů a vytvářejí jakýsi elektronový plyn, který kompenzuje svým záporným nábojem kladný náboj iontů mřížky. Tento druh vazby nazýváme vazbou kovovou. Významná podmínka pro vznik kovové vazby je co nejtěsnější uložení atomů v prostoru. Existence elektronového plynu v kovové mřížce je příčinou velké elektrické a tepelné vodivosti kovů, jejich neprůsvitnosti a vysokého lesku, jakož i snadné tvářitelnosti, tj. vlastností charakterizujících kovy.
Zvlášt velkou elektrickou a tepelnou vodivostí se vyznačují kovy s jedním valenčním elektronem jako Ag, Cu, Au, K nebo Na, protože valenční elektrony jsou v tomto případě slabě vázány. Tepelný pohyb krystalové mřížky vyvolává lokální fluktuace vnitřního elektrického pole, které potom podmiňují další pohyb elektronů v mřížce. Čím bude vyšší teplota krystalové mřížky, tím budou větší fluktuace vnitřního elektrického pole, a tím bude kratší volná dráha téměř volných elektronů elektronového plynu. To tedy znamená, že se u kovů bude se zvyšující se teplotou zmenšovat elektrická vodivost. Také poruchy v krystalové mřížce nedokonalých krystalů ovlivňují lokální fluktuace vnitřního elektrického pole, a tím i vodivost materiálu. Proto mají slitiny zpravidla menší vodivost než čisté kovy.
Kovalentní vazba je tvořena současným sdílením elektronů dvěma atomy. Původ a charakter kovalentní vazby lze pochopit na základě kvantové mechaniky. Čím více se k sobě přibližují dva atomy, tím více se navzájem překrývají elektronové obaly těchto atomů a tím se vytváří pevnější vazba, protože se zmenšuje celková energie atomů. Stupeň překrytí je omezen jednak elektrostatickým odpuzováním obou atomů, jednak tím, že zaplněné orbitaly valenčních elektronů se nemohou překrývat (Pauliho princip). Kovalentní vazba vytváří mezi sousedními atomy stabilní elektronový oktet tím, že se společně sdílí mezi jednotlivými atomy elektronový pár. Tato vazba je tedy podmíněna přítomností nepárových elektronů v jednotlivých valenčních orbitalech atomů. Maximální pravděpodobnost překrytí společných orbitalů je ve směru spojnice atomových jader. V tomto směru je vazba nejpevnější, což znamená, že kovalentní vazba je vazbou směrovou. Příkladem látek tvořících mřížku kovalentní vazbou jsou krystaly uhlíku ve formě diamantu, germanium, křemík atd. Stabilita kovalentní vazb se zmenšuje se zvětšujícím se atomovým číslem prvků.
Iontová vazba je podmíněna přitažlivými elektrostatickými silami, které působí mezi nesouhlasně nabitými ionty a vytváří se mezi atomy se značně rozdílným počtem valenčních elektronů. Protože v souboru iontů každý pozitivní iont přitahuje všechny sousední negativní ionty a naopak, nemůže být iontová vazba směrová. Počet vzájemných vazeb je omezen jednak geometrickým faktorem, který souvisí s nutností co nejtěsnějšího uspořádání krystalové mřížky, jednak s požadavkem elektrické neutrality objemu iontového krystalu. Proto jsou iontové krystaly při pokojových teplotách izolanty a získávají elektrickou vodivost teprve při vyšších teplotách, při kterých tepelná energie umožňuje přechod iontů z jedné mřížkové polohy do druhé. Vedení proudu za přítomnosti vnějšího elektrického pole je pak vázáno na transport hmoty – mluvíme o iontové vodivosti. Iontová vazba se uskutečňuje u alkalických halogenidů typu AIB-I, např. NaCl.
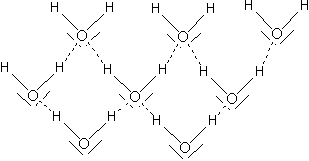
Vedle uvedených primárních vazeb, které mají rozhodující význam, se mohou v pevných látkách uplatnit ještě sekundární vazby projevující se mnohem slabší intenzitou. Kovalentně vázané atomy tvoří často molekuly, které se chovají jako trvalé dipóly. Nejznámějším příkladem je molekula vody. Jelikož elektrony sdílené mezi atomy kyslíku a vodíku se většinu času nacházejí mezi oběma atomy, převažuje na straně atomu kyslíku negativní a na straně vodíku pozitivní konec elektrického dipólu. Pozitivní konce se snaží přitáhnout negativní konce jiných dipólů, čímž jsou molekuly vzájemně svázány. Tento typ vazby se uplatňuje i u jiných sloučenin vodíku a označuje se jako vodíková vazba.
Jiný druh sekundární vazby vzniká jako důsledek pohybu elektronů v obalu atomu. Pohybem elektronů v obalu se mění těžiště záporného náboje obalu vzhledem ke kladnému náboji jádra, čímž se vytváří fluktuující elektrický dipól. Vzájemným působením sousedních dipólů vznikají vazebné síly, které se označují jako van der Waalsovy vazebné síly. Působením van der Waalsových sil se seskupují nejčastěji molekuly a vytvářejí molekulové krystaly, které tvoří např. cukr nebo parafín.
Uvedené typy vazeb představují ideální mezní případy. Ve skutečnosti se však různé typy překrývají, takže se reálné látky tvoří součinností několika typů vazeb. Určit jejich typ a podíl v dané látce je velmi obtížné. U polovodičů jde zpravidla o kovalentní vazbu s částečnou iontovou vazbou. V tomto případě mluvíme o tzv. polárních polovodičích. Příkladem polárního polovodiče je např. GaAs. Podíl iontové vazby lze nejčastěji určit podle rozdílu elektronegativity zúčastněných atomů v elementární buňce. Elektronegativitou rozumíme schopnost atomu přitahovat elektrony, takže alkalické kovy, které jsou v první skupině periodické soustavy prvků, mají malou elektronegativitu, prvky na pravé straně, např. halogeny, mají elektronegativitu velkou.