Mapa analytických reakcí (format .pdf, 104 kB)
Odkaz na stránky o nakládání s nebezpečnými látkami
1. skupina
Vodík
Příprava vodíku v Kippově přístroji
Zn + 2 HCl → ZnCl2 + H2
Třaskavý plyn
2 H2 + O2 → 2 H2O
Tato zkouška je důležitá, pokud pracujeme s vodíkem. Ten se na konci aparatury zapaluje, aby nedošlo k výbuchu musíme se nejdříve přesvědčit, že už v aparatuře není kyslík.
Elektrolýza vody
2 H2O → 2 H2 + O2
Do vody je třeba přidat trochu kyseliny sírove, aby se zvýšila vodivost!
Reakce vodíku ve stavu zrodu
K2Cr2O7 + 4 H2SO2 + 8 H+ → Cr2(SO4)3 + K2SO4 + 7 H2O
Na filtrační papír nasypeme jemně namletý zinek a přefiltrujeme přes něj okyselený roztok dichromanu draselného. Filtrát změnil barvu na zelenou, což je typická barva chromitých solí. Tento jev se vysvětluje tím, že při reakci kyseliny se zinkem na filtračním papiře, vzniká na velmi krátkou dobu vodik ve stavu zrodu(in stati nascenti) a tento vodík má velmi silné redukční účinky.
Alkalické kovy
Plamenové reakce
Používají se v analytické chemii k důkazu iontů některých kovů.
| Prvek | Barva plamene |
|---|---|
| Sodík | Žlutá |
| Draslík | Fialová |
| Rubidium | Červená |
Sodík
Reakce sodíku s vodou
2 Na + 2 H2O → 2 NaOH + H2
Probíhá bouřlivě, ale k zapálení dojde pouze, pokud sodíku zabráníme v pohybu, např. filtračním papírem na hladině vody.
Draslík
Reakce draslíku s vodou
2 K + H2O → 2 KOH + H2
Probíha bouřlivěji než u sodíku a k zapálení vodíku dojde i na volné hladině.
Reakce draslíku s bromem
2 K + Br2 → 2 KBr
Draslik reaguje explozivně s bromem, je to způsobeno velkým rozdílem elektronegativit obou reagujících prvků.
2. skupina
Srážení síranu a šťavelanu
| Ion | SO42- | (COO–)2 |
|---|---|---|
| Ca2+ | Nesráží se | Sráží se okamžitě |
| Sr2+ | Sráží se po chvíli | Sráží se po chvíli |
| Ba2+ | Sráží se okamžitě | Nesráží se |
Hořčík
Hoření hořčíku
2 Mg + O2 → 2 MgO
Hořčík hoří oslnivým, velmi teplým plamenem, nelze hasit vodou, protože má tak vysokou teplotu plamene, že se v něm voda rozkládá na kyslík a vodík, a kyslik podporuje hoření, takže plamen se rozhoří ještě víc.
Vápník
Hydrolýza karbidu vápníku
CaC2 + H2O → 2 H2 + Ca(OH)2
Při hydrolýze se uvolňuje acetylen, který můžeme na konci aparatury zapálit.
13. skupina
Bor
Hoření trimethylesteru kyseliny borité
H3BO3 + 3 CH3OH → B(OMe)3 + 3 H2O
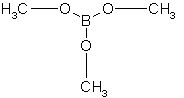
Trimethylester kyseliny borité hoří zeleným plamenem, toho se využívá v analytické chemii, pro detekci i malých množství kyseliny borité.
Hliník
Amfoterita hliníku
Al2(SO4)3 + 6 NaOH → 2 Al(OH)3 + 3 Na2SO4
Al(OH)3 + NaOH → Na[Al(OH)4]
Oxidace hliníku vzdušným kyslíkem
4 Al + 3 O2 → 2 Al2O3
Hliník se na vzduchu pokrývá kompaktní vrstvičkou oxidu hlinitého, která brání jeho další oxidaci, pokud tuto vrstvičku rozrušíme, např. amalgamací bude se povrch hliníku oxidovat a vznikne tzv. hliníkovy květ.
Aluminotermie
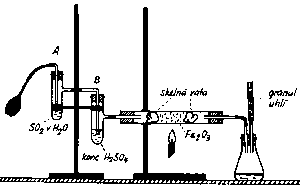
2 Al + Fe2O3 → Al2O3 + 2 Fe
Aluminotermie, je metoda na získávání čistých kovů z oxidů, využívá se vysoké afinity hliníku ke kyslíku. Reakce je silně exotermní, používá se i ke svařování kolejnic. Pokus se provádí v šamotovém kelímku, jako iniciační činidlo je možné použít prskavku, nebo hořčíkovou pásku. Pokud je na dně kelímku udělaná díra, vyteče ven čisté železo.
Reakce hliníku s bromem
4 Al + 3 Br2 → 2 Al2Br6
Reakce hliníku s jodem
4 Al + 3 I2 → 2 Al2I6
Smíchame jemně rozetřený jod s jemným práškovým hliníkem. Reakce se iniciuje kapkou vody, kdy dochází k reakci hliníku s vodou, za vzniku Al(OH)3 tato reakce je velmi exotermická a uvolněné teplo zahájí reakci s jodem.
14. skupina
Uhlík
Dehydratace cukru koncentrovanou kyselinou sírovou
C6H12O6 → 6 C + 6 H2O
Výroba oxidu uhličitého rozkladem uhličitanu vápenatého kyselinou chlorovodíkovou
CaCO3 + 2 HCl → CO2 + CaCl2 + H2O
Krasové jevy
Ca(OH)2 + CO2 → CaCO3 ¯
CaCO3 + CO2 + H2O → Ca(HCO3)2
Ca(HCO3)2 + ΔT → CaCO3 + CO2 + H2O
Hydrolýza karbidu vápníku
CaC2 + 2 H2O → C2H2 + Ca(OH)2
Cín
Reakce cínu s bromem
Sn + 2 Br2 → SnBr4
Redukční účinky chloridu cínatého
3 Sn2+ + 2 CrO42- + 16 H+ → 3 Sn4+ + 2 Cr3+ + 8 H2O
Olovo
Chromová žluť
Pb2+ + CrO42- → PbCrO4
15. skupina
Dusík
Reakce NH3 s HCl
NH3 + HCl → NH4Cl
Pokud necháme vedle sebe stát otevřené láhve s amoniakem a kyselinou chlorovodíkovou, pozorujeme u hrdla vznik bílých dýmu chloridu amonného.
Dimerace NO2 na N2O4
2 NO2 → N2O4
Pokud ochladíme trubici s červenohnědým NO2 pozorujeme odbarvovaní plynu, vzniká bezbarvý dimerní N2O4.
Fosfor
Rozdilná reaktivita červeného a bílého fosforu
4 P + 5 O2 → P4O10
Pásek plechu připevníme do lapáku a položíme na něj kousek bílého a červeného fosforu. Plíšek zahříváme kahanem tak, aby byl plamen blíže červenému fosforu. Nejdříve se vznítí bílý fosfor.
Rozpustnost fosforu v sirouhlíku a samozápalnost bíleho fosforu
Kousek bílého fosforu rozpustíme ve zkumavce v sirouhlíku. Roztokem polejeme filtrační papír, po vypařeni sirouhlíku papír vzplane.
Hydrolýza oxidu fosforečného
P4O10 + 6 H2O → 4 H3PO4
Do kádinky s vodou vhodíme lžicku oxidu fosforečného, pozorujeme prudkou reakci.
Arsen
Marsch-Liebigova zkouška
As2O3 + 6 Zn + 6 H2SO4 → 2 AsH3 + 6 ZnSO4 + 3 H2O
2 AsH3 → 2 As + 3 H2
Analytická zkouška uživaná v soudním lékařství. Oxidačně redukční reakce. Vznik arsanu a jeho rozklad na As.
Gutzeitova zkouška
Ag3As.3AgNO3 + 3 H2O → 6 Ag + As(OH)3 + 3 HNO3
Analytická zkouška na arsen. Do baňky nalejeme malé množství koncentrované HCl, vložíme kousek zinku a přidáme As2O3. K ústí baňky dáme ovlhčený filtrační papír s krystalkem AgNO3. Vytváří se hnědá skvrna, přičemž arsan reaguje s AgNO3 na AsAg3.3AgNO3, který se vodou hydrolyzuje.
Chalkogeny
Síra
Chování síry při zahřívání, plastická síra
Sα → Sβ → Sμ → S(l)
Ve zkumavce zahříváme práškovou síru, nejdříve vznikne žlutá kapalina, která začne postupně tmavnout až do hněda, přičemž silně vzrůstá viskozita, při určité teplotě, okolo 200 °C je viskozita tak vysoká, že můžeme zkumavku otočit dnem vzhůru. Pokud síru dále ohříváme, viskozita klesá. Když siru, která je zahřátá téměř k varu vylejeme do vody, vznikne tzv. plastická síra, která během několika dní přejde na Sα.
Reakce zinku se sírou
Zn + S → ZnS
Smícháme práškový zinek s práškovou sírou a zapálíme, pozorujeme rychlou reakci.
Výroba kyseliny sírové
Kontaktni způsob
2 SO2 + O2 → 2 SO3
SO3 + H2O → H2SO4
Trubici s katalyzátorem zahříváme kahanem, po zahřátí ženeme trubicí SO2 vysušený konc. kyselinou sírovou. Dochází k oxidaci na SO3, který vháníme do vody a vzniká H2SO4.
Komorový způsob
SO2 + NO2 + H2O → H2SO4 + NO
Do trubice ženeme oxid siřičitý a oxid dusičitý, na stěnách trubice se vyloučí bílý síran nitrosylu NOHSO4, který hydrolyzujeme vodou na kyselinu sírovou.
Selen
Redukce seleničitanu na červený selen
2 SeO32- + 4 SO2 + 2 H2O → 2 Se + 4 SO42- + 4 H+
Do roztoku seleničitanu zavedeme SO2. Vyredukuje se červený selen.
Halogeny
Fluor
Leptání skla kyselinou fluorovodíkovou
SiO2 + 4 HF → SiF4 + 2 H2O
3 SiF4 +H2O → SiO2 + 2 H2SiF6
Do kelímku dáme pevný fluorid vápenatý a přidáme koncentrovanou kyselinu sírovou. Překlopíme hodinovým sklíčkem s nápisem HF vyrytým do vosku. Po určité době pozorujeme vyleptaný nápis.
Chlor
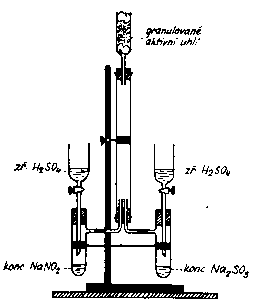
Příprava chloru oxidací kyseliny chlorovodíkové
16 HCl + 2 KMnO4 → 5 Cl2 + 8 H2O + 2 MnCl2 + 2 KCl
Hoření chloru ve vodíku
H2 + Cl2 → 2 HCl
Naplníme válec chlorem a ponoříme do něho hořící vývod z Kippova přístroje na vodík.
Reakce chloru s vodou a vlastnosti chlorové vody
H2O + Cl2 → HCl + HClO
2 HClO → 2 HCl + O2
Chlor se „rozpouští“ ve vodě na chlorovou vodu, dochází k disproporcionační reakci. Chlorem obsaženým v chlorové vodě můžeme vytěsnit brom a jod z bromidu a jodidu.
2 KBr + Cl2 → Br2 + 2 KCl
2 KI + Cl2 → I2 + 2 KCl
Jod
Rozpustnost jodu
Pokud nasypeme krystalky jodu do destilované vody, prakticky se jod nerozpouští, ale pokud do vody přidáme jodid dojde ke vzniku aniontu I3–, který je ve vodě dobře rozpustný. Rozpuštěný jod můžeme vytřepat do organických rozpouštědel, např. benzenu za vzniku tmavěfialového roztoku.
6. skupina
Přechod chromanu na dichroman a obráceně
2 K2CrO4 + H2SO4 → K2Cr2O7 + K2SO4 + H2O
K2Cr2O7 + 2 KOH → 2 K2CrO4 + H2O
K roztoku chromanu draselného přilejeme zředěnou kyselinu sírovou. Žlutá barva roztoku přechází v oranžovou. Přilejeme-li k oranžovému roztoku dichromanu draselného roztok hydroxidu draselného, roztok opět zežloutne.
7. skupina
Tepelný rozklad manganistanu draselného
2 KMnO4 → K2MnO4 + MnO2 + O2
Manganistan zahříváme ve zkumavce. Vznikající kyslík dokážeme zapálenou špejlí.
Dehydratace kyseliny manganisté na oxid manganistý
K manganistanu draselnému ve zkumavce nalijeme kyselinu sírovou, vznikne oxid manganistý, který prudce oxiduje organické látky. Po přikápnutí ethanolu dojde k vzplanutí.
Nejprve dochází k vytěsnění kyseliny manganisté a následně k její dehydrataci:
2 KMnO4 + H2SO4 → 2 HMnO4 + K2SO4
2 HMnO4 → Mn2O7 + H2O
11. skupina
Dehydratace CuSO4.5 H2O
Na krystalky modré skalice ve zkumavce přidáme koncentrovanou H2SO4. Pozorujeme jejich odbarvování.
Komplexotvorné vlastnosti mědi
Cu2+ + 4 NH3 → [Cu(NH3)4]2+
K roztoku modré skalice přidáváme amoniak, nejdříve dojde k vysrážení bazických solí, po dalším přídavku amoniaku se sraženina rozpustí.