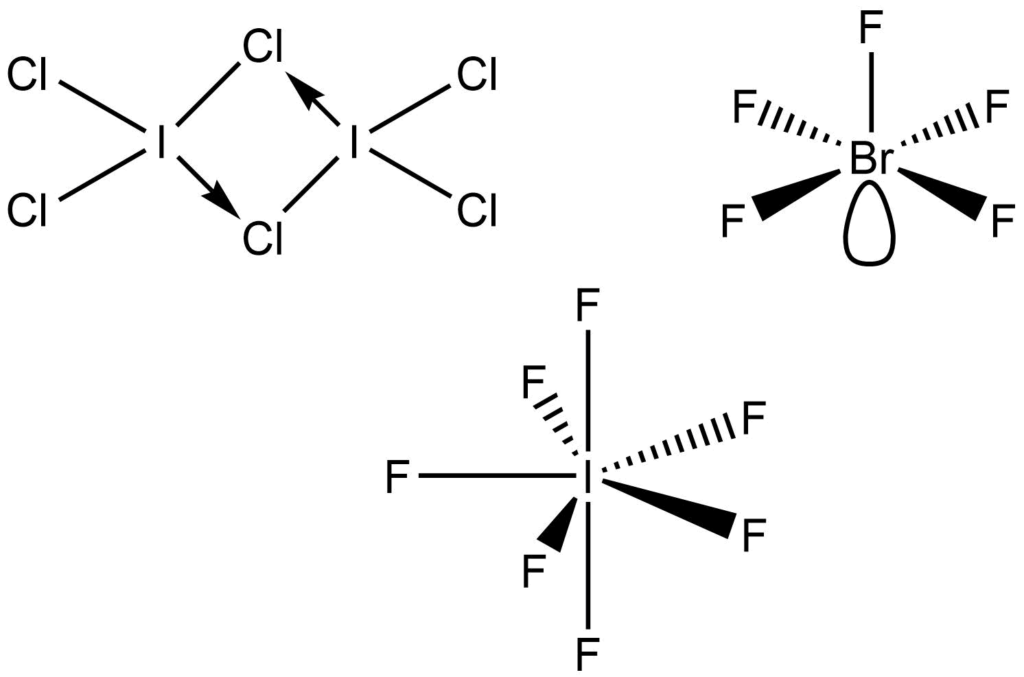
Interhalogeny jsou sloučeniny, ve kterých je kation i anion tvořen halogenem, jejich obecné vzorce jsou XY, XY3, XY5 a XY7. Jejich struktury odpovídají teorii VSEPR, jedinou výjimkou je chlorid joditý, který vytváří dimer I2Cl6.
| Interhalogen | Název | Skupenství | Tvar molekuly |
|---|---|---|---|
| ClF | Fluorid chlorný | Bezbarvý plyn | Lineární |
| BrF | Fluorid bromný | Hnědý plyn | |
| BrCl | Chlorid bromný | V čistém stavu nepřipraven, existuje v rovnováze s molekulárních chlorem a bromem | |
| ICl | Chlorid jodný | Červená pevná látka | |
| IBr | Bromid jodný | Černá pevná látka | |
| ClF3 | Fluorid chloritý | Bezbarvý plyn | Tvar písmene T |
| BrF3 | Bromid chloritý | Žlutá kapalina | |
| IF3 | Jodid chloritý | Žlutá pevná látka | |
| I2Cl6 | Chlorid joditý | Oranžová pevná látka | Dimerní molekula |
| ClF5 | Fluorid chlorečný | Bezbarvý plyn | Tetragonální pyramida |
| BrF5 | Fluorid bromičný | Bezbarvá kapalina | |
| IF5 | Fluorid jodičný | Bezbarvá kapalina | |
| IF7 | Fluorid jodistý | Bezbarvý plyn | Pentagonální bipyramida |
Dvouatomové halogeny (XY) mají vlastnosti, které jsou mezi vlastnostmi odpovídajících halogenů. Pokud je rozdíl elekronegativit X a Y větší je vazba X-Y silnější než X-X a Y-Y. Fluorid chlorný je komerčně dostupný a využívá se jako silné fluorační činidlo.
W + 6 ClF → WF6 + 3 Cl2
ClF + CsF → Cs[ClF2]
S výjimkou I2Cl6, jsou vyšší interhalogenidy velmi reaktivní sloučeniny, reagují prudce s vodou a organickými sloučeninami. ClF3 dokonce dokáže zapálit azbest. Navzdory těmto vlastnostem jde o velmi cenné fluorační činidla. Vysoce reaktivní ClF3 dokáže fluorovat kovy, chloridy a oxidy kovů na příslušné fluoridy. Syntéza UF6 se využívá při zpracování jaderného paliva:
U + 3 ClF3 → UF6 + 3 ClF
Reaktivita interhalogenů klesá v pořadí ClFn > BrFn > IFn. V rámci stejného prvkového složení klesá reaktivita s klesajícím oxidačním číslem kationtu, tj. např. BrF5 > BrF3 > BrF. V souhlase s těmito trendy se IF5 chová jako relativně mírné fluorační činidlo.
Interhalogenidové ionty
| Struktura molekuly | Příklady |
|---|---|
| Lineární | [ClF2]–, [IF2]–, [ICl2]–, [IBr2]– |
| Lomenná | [ClF2]+, [BrF2]+, [ICl2]+ |
| Čtvercově planární | [ClF4]–, [BrF4]–, [IF4]– |
| Houpačka | [ClF4]+, [BrF4]+, [IF4]+ |
| Pentagonálně planární | [IF5]2- |
| Oktaedr | [ClF6]+, [BrF6]+, [IF6]+ |
| Čtvercové antiprizma | [IF8]– |
Literatura
- Kategorie interhalogeny na wikipedii
- GREENWOOD, N.N. a A. EARNSHAW. Chemie prvků. Praha: Informatorium, 1993, s. 1012-1036. ISBN 80-85427-38-9.