Hliník, Al, je nejrozšířenější kov v zemské kůře, jeho obsah činí 8,3 %. Nacházíme ho v mnoha minerálech, např. kaolinitu [Al2(OH)4Si2O5], kryolitu Na3AlF6, spinelu MgAl2O4 a granátu [Ca3Al2(SiO4)3]. Průmyslově je nejdůležitějším minerálem bauxit, AlOOH, který byl objeven roku 1821. Využívá se jako zdroj hliníku při jeho elektrolytické výrobě.
| Atomové číslo | 13 | Počet stabilních izotopů | 1 |
| Atomová hmotnost | 26,9815 | Elektronová konfigurace | [Ne] 3s2 3p1 |
| Teplota tání [°C] | 660,32 | Teplota varu [°C] | 2519 |
| Elektronegativita | 1,61 | Hustota [g.cm-3] | 2,7 |
Izotopy hliníku
Známe celkem 22 jeho izotopů a čtyři jaderné izomery. V přírodě se vyskytuje jako téměř monoizotopický prvek 27Al se stopovým množstvím radioaktivního izotopu 26Al (t1/2 = 7,16×105 roků). Ostatní radioizotopy hliníku mají poločasy rozpadu kratší než 7 minut.
26Al
V přírodě vzniká působením kosmického záření na izotop 40Ar v atmosféře.[8] V zemské kůře vzniká působením kosmického záření na křemík.
Tento izotop se rozpadá za vzniku 26Mg a vyzáření pozitronu (beta plus přeměna), poločas přeměny je 7,16×105 roků.
$$^{26}_{13}\textrm{Al }\rightarrow\ ^{26}_{12}\textrm{Be + }^0_1\textrm{e}^+$$
Datování pomocí 26Al-26Mg
Stanovení zastoupení izotopu 26Al lze využít k datování vzorků meteoritů (i z Měsíce). Koncentrace se dříve stanovovala pomocí aktivity vzorku, dnes se využívá spíše přesnější hmotnostní spektrometrie.[9]
Výroba
Hliník je nejpoužívanějším neželezným kovem, v roce 2005 byla jeho celosvětová produkce 32 miliónů tun. Průmyslová výroba hliníku je zachycena v tomto videu.
Hlavním zdrojem hliníku je minerál bauxit, ten je vyčištěn a převeden na aluminu (Al2O3) pomocí tzv. Bayerova procesu. Nejprve je oxid hlinitý z rudy extrahován převedením na hlinitan reakcí s NaOH v autoklávu:
Al2O3 + 2 NaOH + 3 H2O → 2 Na[Al(OH)4]
Nerozpustné nečistoty jsou odstraněny a hlinitan je ochlazen a hydrolyzován na hydroxid hlinitý:
Na[Al(OH)4] → Al(OH)3 + NaOH
Následnou kalcinací na teplotu 1200 °C získáme aluminu:
2 Al(OH)3 → Al2O3 + 3 H2O
Ta je pomocí Hall–Héroultova procesu redukována na kovový hliník. Redukce probíhá elektrolyticky, pro snížení teploty tání (alumina taje při teplotě 2053 °C) se přidává kryolit (Na3AlF6) jako tavidlo a příměsí CaF2 nebo NaF. Elektrolýza probíhá při teplotě 960 °C, katodou je tavenina hliníku, anodou pak uhlík. Celkovou reakci můžeme zapsat jako:
2 Al2O3 + 3 C → 4 Al + 3 CO2
Společně s oxidem uhličitým dochází i ke vzniku oxidu uhelnatého.
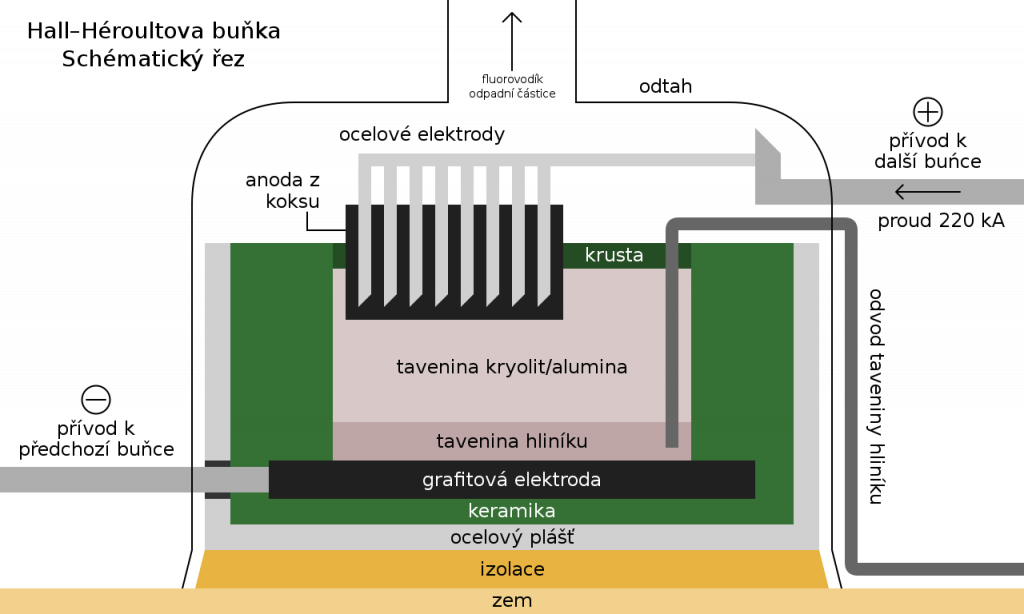
Tavenina hliníku je odebírána a dále zpracovávána podle požadavků zákazníka. Jak je vidět, je výroba hliníku energeticky velmi náročná, proto je vždy situována v blízkosti elektráren.
Využití


Využívá se nejčastěji ve formě slitin. Jeho slitina s niklem se využívá pro přípravu Raneyova niklu.
Pro zvýšení mechanické a chemické odolnosti se povrch hliníku často upravuje tzv. eloxováním neboli anodizací. Tímto procesem se elektrolyticky vytvoří vrstva oxidu hlinitého na povrchu čistého kovu.
Důležitým minerálem hliníku, využívaným ve šperkařství, hodinářství i optice je rubín. Jedná se o modifikaci oxidu hlinitého, čistý je průhledný, zbarvení způsobují příměsi. Jeho název je odvozen od latinského ruber, což je výraz pro červenou barvu, způsobovanou příměsí chromu. Krystaluje v klencové soustavě, těží se hlavně v Barmě, Tanzánii a Pakistánu. Další naleziště jsou Afganistánu, Austrálii, Brazílii, Indii a USA.
Chemické vlastnosti
Oxidy
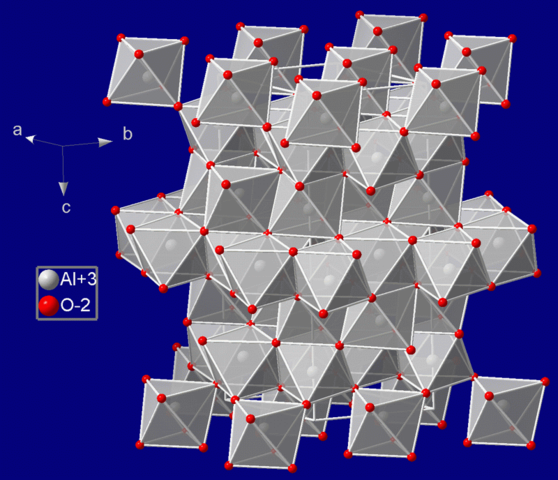
Oxid hlinitý (Al2O3) se vyskytuje v několika krystalových formách, hlavní jsou α-Al2O3 (korund), který krystaluje v těsném hexagonálním uspořádání. A druhou je γ-Al2O3 krystalizující v kubickém uspořádání jako defektní spinelová struktura.
Korund je velmi tvrdý (9 v Mohsově stupnici), chemicky i tepelně odolný, což předurčuje jeho využití jako brusný i žáruvzdorný materiál.
Halogenidy hlinité
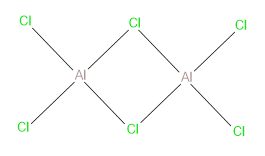
Známe všechny čtyři halogenidy hlinité, jedná se o pevné látky .
| Sloučenina | AlF3 | AlCl3 | AlBr3 | AlI3 |
| Teplota tání [°C] | 1290 | 192,4 | 97,8 | 189,4 |
Fluorid hlinitý se připravuje reakcí oxidu hlinitého s plynným fluorovodíkem při teplotě okolo 700 °C, průmyslová výroba je založena na reakci oxidu hlinitého s kyselinou hexafluorokřemičitou (H2SiF6).
H2SiF6 + Al2O3 → 2 AlF3 + SiO2 + H2O
Využití nachází při průmyslové (elektrolytické) výrobě hliníku.
Chlorid hlinitý je nejdůležitějším halogenidem hlinitým, v čistém stavu je to bílá, krystalická látka, při manipulaci na vzduchu se jeho barva mění na žlutou. Je to silně hygroskopická sloučenina, vytváří oktaedrický kationt [Al(H2O)6]3+, ten už nelze zahříváním převést na bezvodý AlCl3, protože se rozkládá.
[Al(H2O)6]Cl3 → Al(OH)3 + 3 HCl + 3 H2O
Připravuje se reakcí hliníku s chlorem nebo chlorovodíkem za zvýšené teploty.
Poměrně zajímavá je struktura chloridu hlinitého, teorie VSEPR předpovídá planární strukturu (trojúhelník), tu pozorujeme pouze za vysoké teploty. Při teplotě tání a kousek nad ní (150–200 °C) vytváří chlorid hlinitý dimerní molekuly Al2Cl6, oba hliníky mají koordinační číslo 4.
V pevném stavu vytváří vrstevnatou strukturu, hliníky mají koordinační číslo 6.
Bromid hlinitý je dimerní v pevném stavu, tavenině i v roztoku s nekoordinujícími rozpouštědly. Stejně jako dimerní forma chloridu sestává bromid ze dvou teraedrů AlBr4, které sdílejí hranu, molekula patři do grupy symetrie D2h. Monomerní forma byla pozorována pouze v plynné fázi. Připravuje se reakcí kovového hliníku s bromovodíkem nebo bromem. Využívá se jako katalyzátor Friedel-Craftsových syntéz.
Jodid hlinitý je také silně hygroskopická látka, v pevném stavu vytváří dimerní molekuly Al2I6, podobně jako bromid a chlorid. Bezvodý se vyrábí reakcí vodíku s jódem nebo jodovodíkem. Reakce s jódem je exotermní a dochází během k ní k sublimaci nezreagovaného jódu za vzniku intenzivního fialového dýmu. Hexahydrát můžeme vyrobit reakcí hydroxidu hlinitého s kyselinou jodovodíkovou.
V roce 2017 byla publikována příprava první sloučeniny s dvojnou vazbou Al=Al.
Chloridy-alkoxidy hlinité jsou blíže popsány zde.
NMR
Hliník je monoizotopický prvek, 27Al je kvadrupolární jádro s vysokou citlivostí. Pokud je jeho okolí symetrické, poskytuje úzké linie, ale se snižováním symetrie dochází k jejich rozšiřování. Jako standard se používá roztok dusičnanu hlinitého v D2O. Ve spektru je často vidět i signál pocházející ze sondy, široký hrb okolo 80 ppm.
| 27Al | |
|---|---|
| Spin | 5/2 |
| Zastoupení v přírodě [%] | 100 |
| Rozsah chemických posunů | 200 – (-200) ppm |
| Citlivost vzhledem k 1H | 0,20689 |
| Citlivost vzhledem k 13C | 1220 |
| Rezonanční frekvence v poli 1 T | 11,1031 |
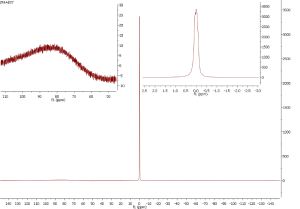
Interakční konstanty
Rozsahy interakčních konstant 27Al s jinýmy jádry
| Spinový systém | 1J | 2J | 3J |
|---|---|---|---|
| 27Al–1H | 39–241 | 6–9 | 6 |
| 27Al–2H | – | 9 | – |
| 27Al–11B | – | 9 | – |
| 27Al–13C | 7–191 | 1–15 | – |
| 27Al–14N | 22–45 | – | – |
| 27Al–15N | 44 | – | – |
| 27Al–19F | 18–20 | – | – |
| 27Al–29Si | – | 1–4 | – |
| 27Al–31P | 92–300 | 11–53 | – |
| 27Al–35Cl | 650 | – | – |
| 27Al–81Br | 750 | – | – |
Odkazy
- Alkoxidy hlinité
- Chloridy-alkoxidy hlinité
- Hliník na české wikipedii
- Hliník na anglické wikipedii
- 27Al NMR
- Controlled step-wise isomerization of the Keggin-type Al13 and determination of the γ-Al13 structure – příprava Kegginových struktur Al13 částečnou hydrolýzou AlCl3 pomocí Ca(OH)2
- Recent advances in application of 27Al NMR spectroscopy to materials science
- Cosmogenic 26Al in the atmosphere and the prospect of a 26Al/10Be chronometer to date old ice
- 26Al depth profile in Apollo 15 drill core
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
10 Replies to “Hliník”