Ruthenium, Ru, je přechodný prvek patřící mezi platinové kovy. Stejně jako ostatní platinové kovy je poměrně nereaktivní.
| Atomové číslo | 44 | Počet stabilních izotopů | 7 |
| Atomová hmotnost | 101,07 | Elektronová konfigurace | [Kr] 4d7 5s1 |
| Teplota tání [°C] | 2334 | Teplota varu [°C] | 4150 |
| Elektronegativita | 2,2 | Hustota [g.cm-3] | 12,45 |
V přírodě je vzácný, roční produkce je cca 12 tun. Získává se z niklových a měděných nalezišť, a z rud jiných platinových kovů.
Ruthenium se využívá ve slitinách s platinou pro zlepšení jejich mechanických vlastností. Slitiny s titanem mají velmi dobrou korozní odolnost, také jej nacházíme v katalyzátorech na odstraňování sulfanu z ropy.
Izotopy
Přírodní ruthenium se skládá ze sedmi stabilních izotopů, resp. pěti stabilních a dvou tzv. pozorovatelně stabilních. To znamená, že se předpokládá nestabilita těchto jader, ale poločas přeměny je extrémně dlouhý a proto nebyla dosud pozorována.[4]
| Izotop | Zastoupení v přírodě [%] | Stabilita |
| 96Ru | 5,54 | Pozorovatelně stabilní |
| 98Ru | 1,87 | Stabilní |
| 99Ru | 12,8 | Stabilní |
| 100Ru | 12,6 | Stabilní |
| 101Ru | 17,1 | Stabilní |
| 102Ru | 31,6 | Stabilní |
| 104Ru | 18,6 | Pozorovatelně stabilní |
Dále známe 27 radioizotopů, nejstabilnější jsou 106Ru s poločasem přeměny 373,6 dne a 97Ru s poločasem přeměny 2,9 dne.
97Ru
Připravuje se z rhodia ostřelováním protony nebo molybdenu ostřelováním α částicemi:
$$^{103}_{\ \ 45}\textrm{Rh + }^1_1\textrm{p }\rightarrow\ ^{97}_{44}\textrm{Ru + 2 }^1_1\textrm{p + }5\ ^1_0\textrm{n}\\
^{94}_{42}\textrm{Mo + }^4_2\alpha\ \rightarrow\ ^{97}_{44}\textrm{Ru + }^1_0\textrm{n}\\
^{95}_{42}\textrm{Mo + }^4_2\alpha\ \rightarrow\ ^{97}_{44}\textrm{Ru + 2 }^1_0\textrm{n}$$
Přeměňuje se elektronovým záchytem na 97Tc.
Komplexy s tímto izotopem se využívají v nukleární medicíně.
106Ru
Získává se jako produkt štěpení 235U, z vyhořelého jaderného paliva, často využitím procesu PUREX. Další možností je ozařování dusičnanu uranylu, UO2(NO3)2, v jaderném reaktoru.
Přeměna probíhá mechanismem β–, poločas přeměny je 373,6 dne:
$$^{106}_{\ \ 44}\textrm{Ru }\rightarrow\ ^{106}_{\ \ 45}\textrm{Ru }+\ ^{\ \ \ 1}_{-1}\beta$$
Chemické vlastnosti
Vytváří sloučeniny v oxidačních číslech –II, 0 až +VIII. Jako jeden ze tří prvků PSP vytváří oxid v oxidačním čísle VIII. V bazickém roztoku tento oxid přechází na [RuO4]–, při vyšší koncentraci hydroxidu až na [RuO4]2- a dochází k vývoji kyslíku.
Ruthenidy (Ru-II) jsou poměrně vzácné, tvoří některé supravodivé materiály, např. CeRu2.
Oxidy
RuO2 je modrá až černá látka, krystalující ve struktuře rutilu, připravuje oxidací ruthenia kyslíkem při 1000 °C. RuO4 je žlutá, těkavá látka s teplotou tání 25 °C a varu 40 °C. Je méně stabilní než oxid osmičelý, v roztocích alkalických hydroxidů se redukuje až na RuO42-. Zahřátím nad 1000 °C se za exploze rozkládá na oxid rutheničitý a kyslík. Jde o velmi silné oxidační činidlo, v přítomnosti organických látek exploduje.
Ruthenistany
Ruthenistany jsou soli s aniontem RuO4–, ruthenium zde má oxidační číslo VII. Jsou slabší oxidační činidla než např. manganistany, dokáží ale oxidovat hydroxid na kyslík za vzniku ruthenanu:
4 KRuO4 + 4 KOH → 4 K2RuO4 + 2 H2O + O2
Připravují se redukcí oxidu rutheničelého alkalickým hydroxidem:
4 RuO4 + 4 KOH → 4 KRuO4 + 2 H2O + O2
Ruthenistan tetrapropylamonný (TPAP, tetrapropylammonium perruthenate) se využívá jako oxidační činidlo v organické syntéze. Oxiduje alkoholy na aldehydy, příp. ketony.
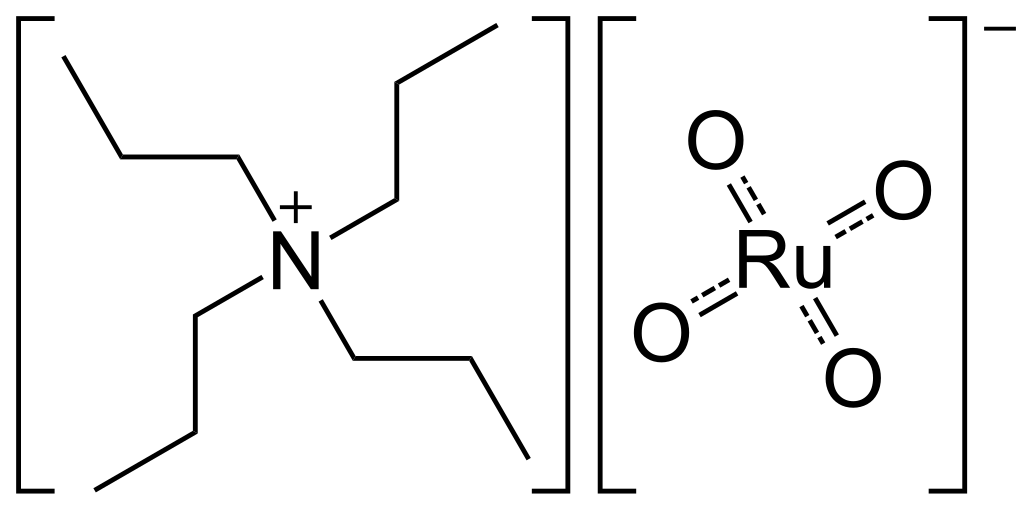
Reaktivita ruthenia
Medicína
Komplexy ruthenia v oxidačním stavu +II jsou potenciálně velmi zajímavé pro medicinální účely. Vykazují protinádorové účinky, důležitou skupinou jsou tzv. komplexy ve tvaru klavírní stoličky (Piano-stool).[5]
NMR
Ruthenium má dva NMR aktivní izotopy, častěji se využívá 99Ru, protože má nižší kvadrupolární moment. Využití nachází v oblasti anorganické a organokovové chemie. Standardem je roztok K4[Ru(CN)6] v D2O. Nízká rezonanční frekvence obou jader způsobuje deformaci baseliny spektra vlivem acousting ringingu. Problematické jsou sloučeniny RuIII, které jsou paramagnetické.
| 99Ru | 101Ru | |
| Spin | 3/2 | 5/2 |
| Zastoupení v přírodě [%] | 12,72 | 17,07 |
| Rezonanční frekvence v poli 1 T | 1,9553 | 2,11916 |
| Jaderný magnetický moment | -0,6413 | -0,7188 |
| Citlivost vůči 1H | 0,00113 | 0,00159 |
Odkazy
- Ruthenium na české wikipedii
- Ruthenium na anglické wikipedii
- Brevard, Ch.; Granger, P. Chem. 1983, 22, 532-535. Ruthenium NMR spectroscopy: a promising structural and analytical tool. General trends and applicability to organometallic and inorganic chemistry
- HÁLA, Jiří. Radioaktivní izotopy. Tišnov: Sursum, 2013. ISBN 978-80-7323-248-1.
- Sojka, M.; Gamez, P. Coord. Chem. Rev., 2025, 543, 216902
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
One Reply to “Ruthenium”