Zinek, Zn, je průmyslově významný, lehce tavitelný kov. Nachází se ve 12. skupině periodické tabulky prvků. Využívá se ve slitinách, pigmentech a barvivech a také jako povrchová úprava kovů.
| Atomové číslo | 30 | Počet stabilních izotopů | 5 |
| Atomová hmotnost | 65,409 | Elektronová konfigurace | [Ar] 3d10 4s2 |
| Teplota tání [°C] | 419,53 | Teplota varu [°C] | 906,85 |
| Elektronegativita | 1,65 | Hustota [g.cm-3] | 7,14 |

Izotopy
Zinek má pět stabilních izotopů, ale pouze 67Zn je NMR aktivní.
| Izotop | Přirozené zastoupení [%] |
|---|---|
| 64Zn | 49,17 |
| 66Zn | 27,73 |
| 67Zn | 4,04 |
| 68Zn | 18,45 |
| 70Zn | 0,61 |
Výskyt a výroba
Nejběžnější zinkou rudou je sfalerit ZnS, další je potom smithsonit ZnCO3. Zinek se vyrábí pražením sfaleritu na vzduchu, vzniklý oxid zinečnatý se redukuje uhlím nebo rozkládá elektrolyticky.
2 ZnS + 3 O2 → 2 ZnO + 2 SO2
2 ZnO + C → 2 Zn + CO2
Při elektrolytické výrobě se nejprve oxid zinečnatý převede na síran, který se následně elektrolyticky redukuje na kovový zinek:
ZnO + H2SO4 → ZnSO4 + H2O
2 ZnSO4 + 2 H2O → 2 Zn + 2 H2SO4 + O2
Objem jeho výroby je čtvrtý nejvyšší, hned po železe, mědi a hliníku. Pohybuje se okolo 6 miliónů tun ročně.
Chemické vlastnosti
Zinek vytváří sloučeniny v oxidačních stavech I a II. Zinečnaté jsou běžnější a stabilnější. Sloučeniny v oxidačním stavu I jsou, podobně jako rtuťné soli, tvořeny iontem Zn22+. Reaguje se silnými minerálními kyselinami za vzniku vodíku, čehož se využívá při laboratorní přípravě malých množství vodíku. V bazických roztocích se zinečnaté soli srážejí jako Zn(OH)2.
Za laboratorní teploty nereaguje se vzduchem, ani s vodou. Za vysokých teplot hoří na oxid zinečnatý (ZnO).
Oxidační stav I
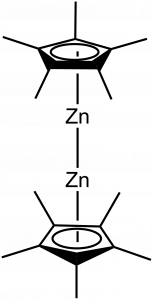
Sloučeniny v oxidačním čísle I jsou u zinku poměrně vzácné a vyžadují velký ligand, který tento nízký oxidační stav stabilizuje. Zpravidla se jedná o dvojjaderné ionty, podobně jako u sloučenin rtuťných. První sloučeninou ZnI byl dekamethyldizinkocen [Zn2(η5–C5Me5)2].
Oxidační stav II
Zinečnaté sloučeniny jsou nejběžnější, zinek v nich má elektronovou konfiguraci d10, proto jsou bezbarvé a diamagnetické.
Organokovové sloučeniny
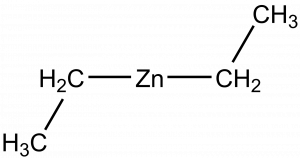
Organozinečnaté sloučeniny se využívají jako reagenty v organické chemii. Diethylzinek (Et2Zn) byl první připravenou sloučeninou se sigma vazbou mezi zinkem a uhlíkem.[5]
NMR
Jádro 67Zn je kvadrupolární a má velmi nízkou citlivost. Poskytuje široké signály. Jelikož je většina NMR sond vyrobena ze slitiny zinku je ve spektru patrný i široký signál sondy. Jako standard se využívá nasycený roztok dusičnanu zinečnatého v D2O.
| 67Zn | |
| Spin | 5/2 |
| Zastoupení v přírodě [%] | 4,1 |
| Citlivost vzhledem k 1H | 1,18×10-4 |
| Citlivost vzhledem k 13C | 0,692 |
| Rozsah chemických posunů | 250 – -2700 ppm |
| Rezonanční frekvence v poli 1 T | 2,6694 |
| Jaderný magnetický moment | +0,875479 |
Chemické posuny
| Zn2+ | 250 – -50 |
| Nasycený roztok Zn(CO3)2 v D2O | 0 |
| LiZn | -2600 |
Odkazy
- Zinek na české wikipedii
- Zinek na anglické wikipedii
- Zinc NMR
- B. W. Epperlein, H. Krueger, O. Lutz, A. Schwenk, „Fourier transform nuclear magnetic resonance studies of zinc-67“ Z. Naturforschung A., 29, 1553-1557 (1974).
- Zinc Alkyls, Edward Frankland, and the Beginnings of Main-Group Organometallic Chemistry
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
4 Replies to “Zinek”