Fáze je část systému, ve které jsou fyzikální vlastnosti látky a chemické složení stejné. V daném systému často různé fáze odpovídají různým skupenstvím, ale nemusí to být nutně pravda.
Např. sklenice s vodou a ledem je dvoufázová soustava – led a kapalná voda, tady má tedy každá fáze jiné skupenství. Naproti tomu v dvoufázové soustavě tvořené olejem a vodou mají obě fáze stejné skupenství.
Každá fáze může být tvořena jednou nebo více složkami.
Fázové rovnováhy jsou takové rovnováhy, kde nedochází k chemické reakci (na rozdíl od chemické rovnováhy), ale pouze se mění množství a identita fází.
Gibbsův zákon fází
Vyjadřuje vztah mezi počtem fází, složek a stupňů volnosti daného systému.
v + f = s + 2
- s – počet složek v systému
- f – počet fází v systému
- v – počet stupňů volnosti – počet nezávislých intenzivních veličin, které můžeme měnit, aniž by došlo k porušení rovnováhy
- intenzivní veličina – stavové veličiny, např. teplota a tlak. Nejsou aditivní, tzn. např. při sloučení dvou systému se nerovná výsledná hodnota stavové veličiny součtu hodnot veličiny jednotlivých systémů.
Pokud máme jednosložkový dvoufázový systém, např. můžeme nezávisle měnit jen jednu veličinu (v = s + 2 – f = 1 + 2 – 2 = 1), tlak nebo teplotu, aniž by došlo ke změně počtu fázi. V trojném bodě spolu koexistují všechny tři fáze dané látky, stupeň volnosti je pak roven nule. Nemůžeme tedy měnit žádnou veličinu, aniž by došlo ke změně počtu fází.
Jednosložkové fázové rovnováhy
Pokud je počet složek roven jedné, zjednoduší se vztah na formu:
v + f = 3
Příkladem může být voda, jejíž p-T fázový diagram je na obrázku dole.
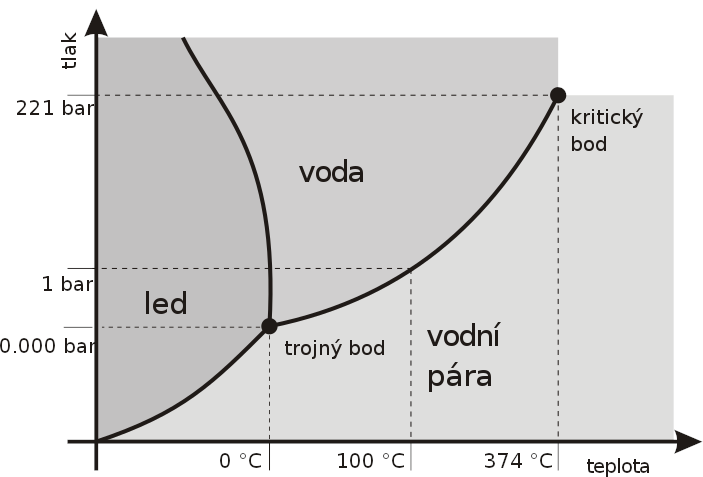
Plochy ohraničené křivkami odpovídají oblasti existence jedné fáze, čili jde o oblasti, kde je počet stupňů volnosti dva, tzn. že můžeme měnit tlak i teplotu libovolně a počet fází se nezmění. Samozřejmě toto platí pouze v omezené míře, nesmíme se dostat na žádnou z křivek.
Křivky odpovídají dvoufázovým soustavám, kde je počet stupňů volnosti roven jedné, tzn. můžeme měnit nezávisle jednu veličinu a druhá se bude měnit závisle, tak abychom se pohybovali po křivce. Přechodem přes křivku dochází ke změně skupenství systému.
V průsečíku křivek se nachází trojný bod, což je bod, ve kterém existují všechny tři fáze najednou, počet stupňů volnosti je nula. Pro vodu je to při teplotě 0,01 °C (273,16 K) a tlaku 0,612 kPa. Změna kterékoliv veličiny vede ke změně počtu fází.
Křivka oddělující oblast kapalné vody a páry (křivka vypařování/kondenzace) končí tzv. kritickým bodem. To je hodnota teploty a tlaku (pro vodu 374,15 °C a 22,12 MPa), kdy vymizí rozhraní mezi kapalnou a plynnou fází a systém se dostane do tzv. superkritického stavu.
Zobrazený fázový diagram je pouze částečný, kompletní by byl složitější. U vody známe minimálně 15 modifikací ledu.
Dvousložkové fázové rovnováhy
Rovnováha kapalina-pára
Nejprve se podíváme na dvě neomezeně mísitelné kapaliny. Chování plynné fáze popisuje Raoltův zákon, který vyjadřuje vztah mezi složením kapalné fáze a tenzí páry dané látky.
$$\textrm{p}_\textrm{i} = \textrm{p . } \textrm{X}_\textrm{i} = \textrm{p . } \frac{\textrm{n}_\textrm{i}}{\textrm{n}}$$
Parciální tlak dané složky v plynné fázi je roven součinu molárního zlomku dané složky v roztoku a celkového tlaku plynné fáze.
Izobarický fázový diagram této soustavy lze použít pro řešení izolace složek ze směsi pomocí destilace.
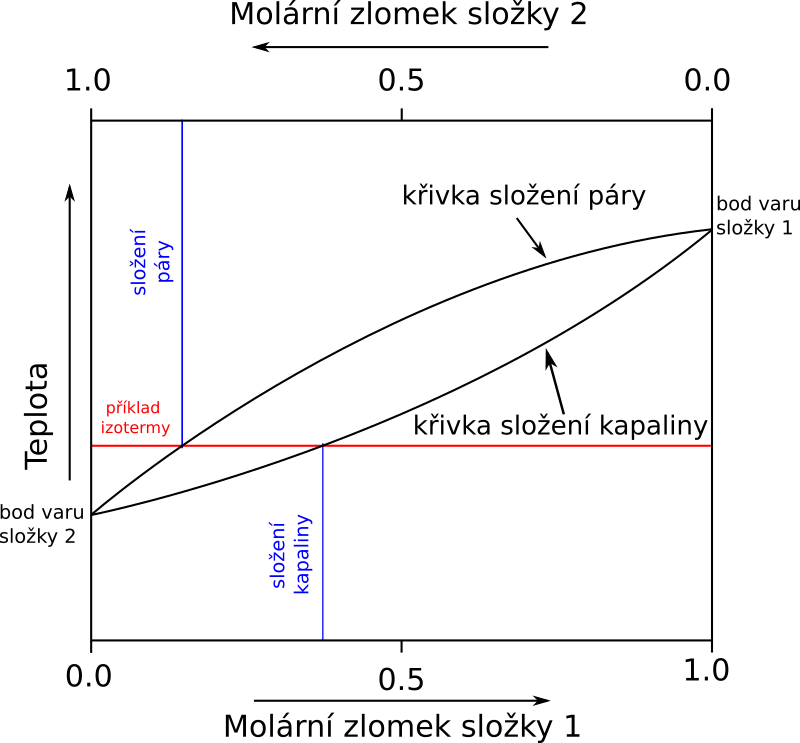
Na diagramu je znázorněna destilace kapaliny, její složení ukazuje modrá úsečka (označení složení kapaliny). Průsečíkem s křivkou diagramu zjistíme teplotu varu směsi. Složení destilátu zjistíme tak, že vedeme přímku (izotermu) rovnoběžnou s osou x, která prochází průsečíkem. V místě kde protne křivku složení páry, odečteme koncentraci destilátu. Vidíme, že došlo ke zvýšení koncentrace složky s nižší teplotou varu.
Fázový diagram zobrazený výše ukazuje chování dvousložkové soustavy, ve které jednotlivé složky mezi sebou neinteragují. Pokud dochází k interakci pomocí vodíkových vazeb pozorujeme existenci směsi s maximální, příp. minimální teplotou varu a označujeme je jako azeotropické směsi. Tyto směsi nelze rozdělit pomocí destilace, protože složení destilátu je stejné jako složení výchozí směsi.
Následující obrázky ukazují obě možnosti. Směs chloroformu a methanolu vykazuje minimum teploty varu, zatímco směs vody a kyseliny mravenčí maximum teploty varu.
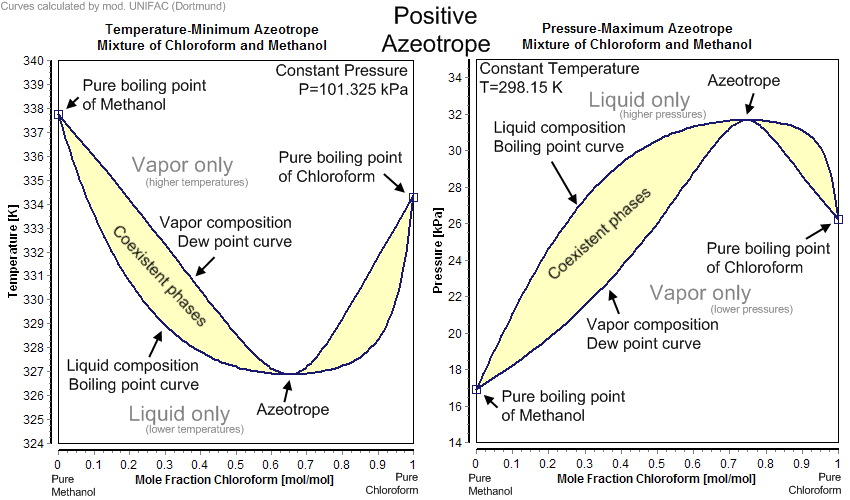

Kromě binárních azeotropických směsí známe i tří a vícesložkové směsi, např. směs chloroformu, methanolu a acetonu.
Dělení těchto směsí se provádí často přidáním další složky, která změní chování směsi a umožní její destilaci. Např. azeotropní směs vody s ethanolem lze rozdestilovat po přidání benzenu.
Rovnováhy v kondenzovaných systémech
Eutektikum
Eutektikum je směs dvou látek mísitelných v kapalném stavu, ale nemísitelných v pevné fázi. Tuhne při určité teplotě, která může být nižší než jsou teploty tání čistých látek.
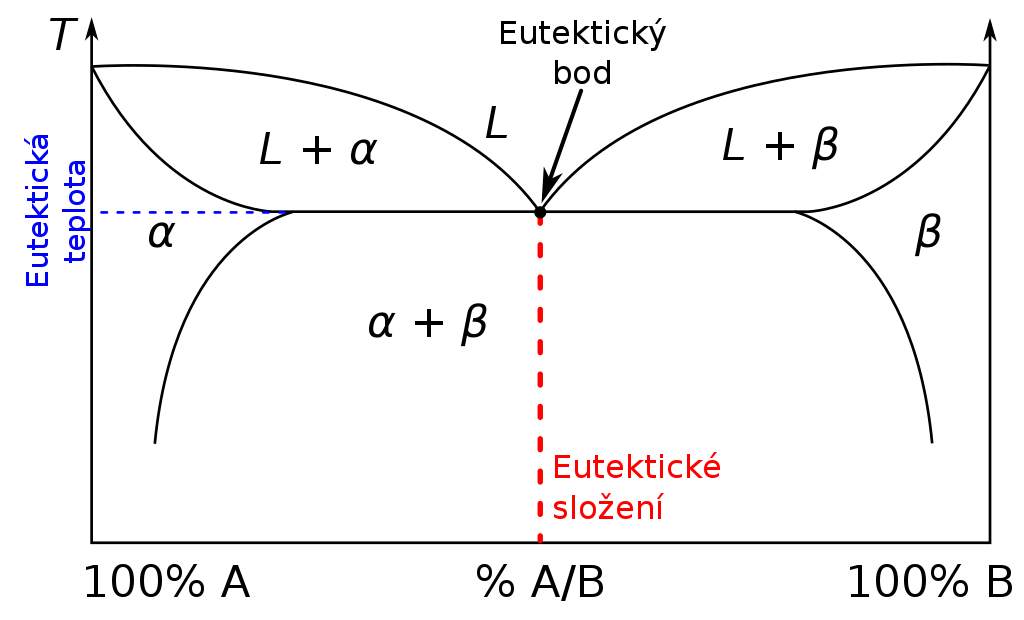
Tuhnutím vznikají dvě fáze s rozdílným složením, což lze pozorovat pomocí mikroskopu.
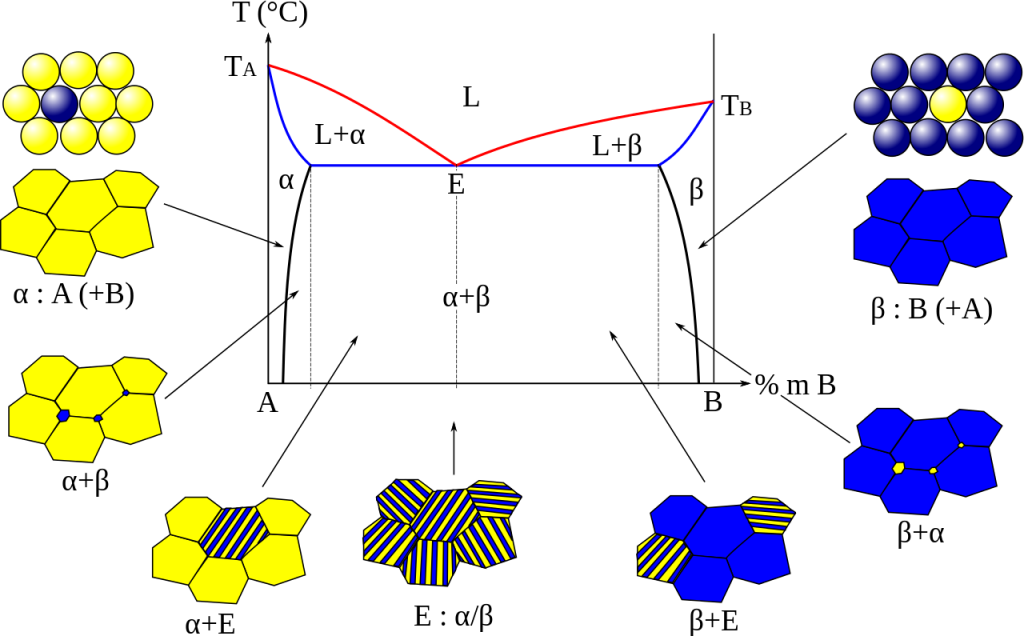
Příkladem eutektické směsi je např. NaK, což je slitina sodíku a draslíku, která je za pokojové teploty kapalná. Využívá se např. pro sušení rozpouštědel nebo jako chladící médium jaderných reaktorů. Dalšími příklady jsou gallinstan (Ga+In+Tl) nebo Woodův kov (Bi+Pb+Sn+Cd).
Další kapitoly
- České chemické názvosloví
- Platné číslice a měření
- Základní chemické zákony
- Důležité veličiny a vztahy v chemii
- Výpočet stechiometrického vzorce
- Chemické rovnice a stechiometrické výpočty
- Koncentrace roztoků
- Rozpustnost, součin rozpustnosti
- Stavba atomu
- Periodická tabulka prvků a periodicita vlastností
- Chemická vazba
- VSEPR
- Komplexní sloučeniny
- Magnetické vlastnosti látek
- Termodynamika
- Chemická rovnováha
- Skupenské stavy látek
- Fázové rovnováhy
- Teorie kyselin a zásad
- pH, aktivita roztoku
- Elektrochemie
- Symetrie molekul
- Laboratorní technika
- Lineární regrese
- Jednotky tlaku
- Jednotky teploty
- Mohsova stupnice tvrdosti minerálů
- Odkazy
- Prezentace k semináři z obecné chemie