Jako koligativní se označují vlastnosti roztoků, které závisí pouze na molární koncentraci rozpuštěných částic, ale nezávisí na jejich vlastnostech, např. na jejich náboji.
Pokud jsou v rozpouštědle rozpuštěny iontové látky, musíme brát v úvahu koncentraci iontů, nikoliv koncentrace samotné rozpuštěné látky. Např. 1 dm3 roztoku Na2SO4 o koncentraci 1 M obsahuje celkem 3 moly iontů:
$$\textrm{Na}_2\textrm{SO}_4\ \rightarrow\ 2\ \textrm{Na}^+\ +\ \textrm{SO}_4^{2-}$$
Mezi koligativní vlastnosti patří:
- zvýšení teploty varu
- snížení teploty tání
- snížení tenze par roztoku
- osmotický tlak
Zvýšení teploty varu
Zvýšení teploty varu rozpouštědla po rozpuštění netěkavé látky označujeme jako ebulioskopický efekt. Na tomto jevu je založena metoda ebulioskopie, která se využívá ke stanovení molární hmotnosti.
$$\textrm{T}_\textrm{v}\ -\ \textrm{T}_\textrm{v}^*\ =\ \textrm{K}_\textrm{E}\ .\ \textrm{c}_\textrm{M}$$
kde Tv je teplota varu roztoku, Tv* je teplota varu čistého rozpouštědla, KE je ebulioskopická konstanta a cM je molální koncentrace (do výpočtu molality musíme zahrnout všechny ionty vzniklé rozpuštěním látky).
Ebulioskopické konstanty rozpouštědel
| Rozpouštědlo | KE [°C.kg.mol-1] |
| Aceton | 1,67 |
| Benzen | 2,65 |
| Chloroform | 3,88 |
| Ethanol | 1,22 |
| Voda | 0,512 |
Snížení teploty tání
Snížení teploty tání rozpouštědla po rozpuštění netěkavé látky označujeme jako kryoskopický efekt. Na tomto jevu je založena metoda kryoskopie, která se využívá ke stanovení molární hmotnosti. Na rozdíl od ebulioskopie, je kryoskopie prakticky nezávislá na atmosférické tlaku.
$$\textrm{T}_\textrm{t}^*\ -\ \textrm{T}_\textrm{t}\ =\ \textrm{K}_\textrm{K}\ .\ \textrm{c}_\textrm{M}$$
kde Tt je teplota tání roztoku, Tt* je teplota tání čistého rozpouštědla, KK je kryoskopická konstanta a cM je molální koncentrace (do výpočtu molality musíme zahrnout všechny ionty vzniklé rozpuštěním látky).
Kryoskopické konstanty rozpouštědel
| Rozpouštědlo | KK [°C.kg.mol-1] |
| Anilin | -5,87 |
| Benzen | -5,12 |
| Chloroform | -4,90 |
| Ethanol | -1,99 |
| Voda | -1,86 |
Osmotický tlak
Osmotický tlak je tlak toku rozpouštědla pronikajícího přes polopropustnou membránu do roztoku, ve kterém je vyšší koncentrace rozpuštěných molekul nebo iontů.
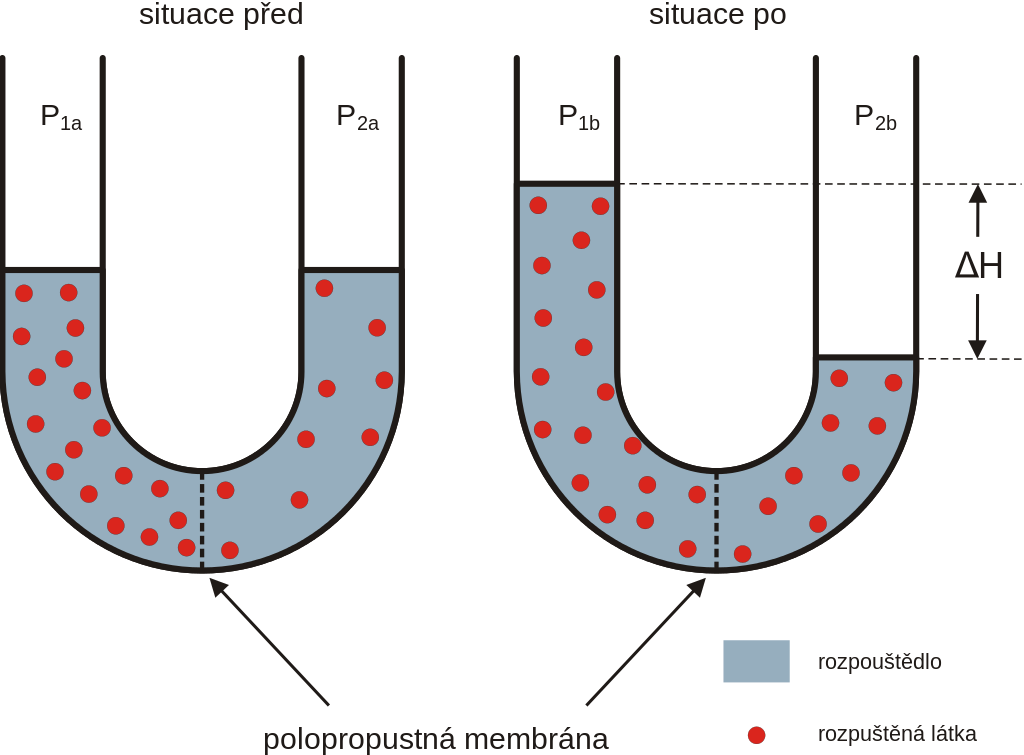
Obrázek ukazuje průběh osmózy, U-trubice je rozdělená polopropustnou membránou. Tato membrána umožňuje průchod rozpouštědlu, ale ne rozpuštěné látce. Vlivem koncentračního gradientu proniká rozpouštědlo do koncentrovanějšího roztoku a snižuje jeho koncentraci.
Osmotický tlak se značí písmenem π, jeho jednotkou je Pascal a je dán vztahem:
π = c . R . T
kde c je molární koncentrace, R je molární plynová konstanta a T je termodynamická teplota [K].
Další kapitoly
- České chemické názvosloví
- Platné číslice a měření
- Základní chemické zákony
- Důležité veličiny a vztahy v chemii
- Výpočet stechiometrického vzorce
- Chemické rovnice a stechiometrické výpočty
- Koncentrace roztoků
- Rozpustnost, součin rozpustnosti
- Stavba atomu
- Periodická tabulka prvků a periodicita vlastností
- Chemická vazba
- VSEPR
- Komplexní sloučeniny
- Magnetické vlastnosti látek
- Termodynamika
- Chemická rovnováha
- Skupenské stavy látek
- Fázové rovnováhy
- Teorie kyselin a zásad
- pH, aktivita roztoku
- Elektrochemie
- Symetrie molekul
- Laboratorní technika
- Lineární regrese
- Jednotky tlaku
- Jednotky teploty
- Mohsova stupnice tvrdosti minerálů
- Odkazy
- Prezentace k semináři z obecné chemie