Periodická tabulka má poměrně bohatou historii, ale než se dostala do dnešní podoby prošla poměrně zajímavým vývojem. Jedním z prvních pokusů o uspořádání známých prvků byl seznam prvků od Lavoisiera z roku 1789 (Traité Élémentaire de Chimie), v té době bylo známo 33 prvků (resp. jednoduchých látek, o kterých předpokládal, že je nelze dále dělit na menší části), které Lavoisier rozdělil do čtyř skupin na plyny, kovy, nekovy a zeminy.
V 19. století počet objevených prvků narůstal a tím se i zvyšovala snaha po nalezení klíče, podle nějž by šly prvky klasifikovat a dělit. Poměrně pěkný text o historii lze najít na wikipedii. Základy pro současnou podobu tabulky položil ruský chemik Dmitrij Mendělejev, který v roce 1869 formuloval periodický zákon pro chemické prvky a známé prvky seřadil do tabulky podle jejich narůstající atomové hmotnosti. Kromě toho předpověděl vlastnosti několika, v té době, neznámých prvků a jeho předpověď byla velice přesná. Stěžejní práce byla publikována v roce 1870 – Die Natur der chemischen Elemente als Function ihrer Atomgewichte.
Moderní periodická tabulka prvků
Nejběžnější je tzv. krátká tabulka, kde jsou f-prvky (lanthanoidy a aktinoidy) vyčleněny do spodní části tabulky. Prvky jsou uspořádány podle vzrůstajícího protonového čísla a jsou rozděleny do skupin a period. Ve skupinách jsou prvky se stejným počtem valenčních elektronů, díky podobné elektronové konfiguraci mají také podobné chemické vlastnosti. V periodách jsou prvky, jejichž valenční elektrony obsazují stejnou elektronovou hladinu.
Prvky můžeme také rozdělit podle typu posledního obsazeného orbitalu na tzv. bloky. Známe čtyři bloky – s, p, d a f. Podle fyzikálních a chemických vlastností rozdělujeme prvky do tří skupin – kovy, polokovy a nekovy.
Periodickou tabulku prvků z dílny studentů MU si můžete stáhnout zde.
Skupiny prvků
Známe 18. skupin, skupiny nepřechodných prvků mají zavedený i triviální název a existují pro ně i mnemotechnické pomůcky.
1. skupina (Alkalické kovy): Hana Líbá Na Křižovatce Robustního Cestáře Frantu
2. skupina (Kovy alkalických zemin): Běžela Magda Caňonem, Srazila Banán Ramenem
13. skupina (Triely): Byl Alexej Gagarin Indickým Tlumočníkem?
14. skupina (Tetrely): Copak Si Gertruda Snědla Plombu
15. skupina (Pentely): Náš Pan Asistent Sbírá Bikiny
16. skupina (Chalkogeny): Ó Slečny Sejměte Tenké Podkolenky
17. skupina (Halogeny): Franta Cloumal Bromem Jako Atlet
18. skupina (Inertní plyny): Helena Nese Arašídy Králi Xenonu Ráno
Jména prvků 113, 115, 117 a 118
Organizace IUPAC vydala 9. 6. 2016 návrhy na názvy čtyř prvků ze 7. periody PSP. Tyto názvy byly schváleny 28. listopadu 2016, čímž byla 7. perioda kompletně zaplněna.
| Protonové číslo | Dřívější název (značka) | Současný název (značka) |
|---|---|---|
| 113 | Ununtrium (Uut) | Nihonium (Nh) |
| 115 | Ununpentium (Uup) | Moscovium (Mc) |
| 117 | Ununseptium (Uus) | Tennessine (Ts) |
| 118 | Ununoctium (Uuo) | Oganesson (Og) |
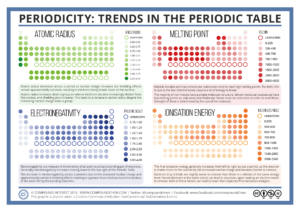
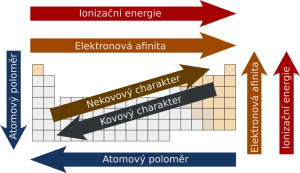
Periodicita vlastností prvků
Vlastnosti prvků odpovídají umístění prvku v PSP, podobnost prvků v rámci skupiny je dána podobnou konfigurací valenční elektronové vrstvy.
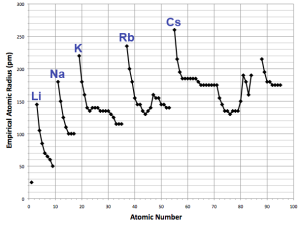
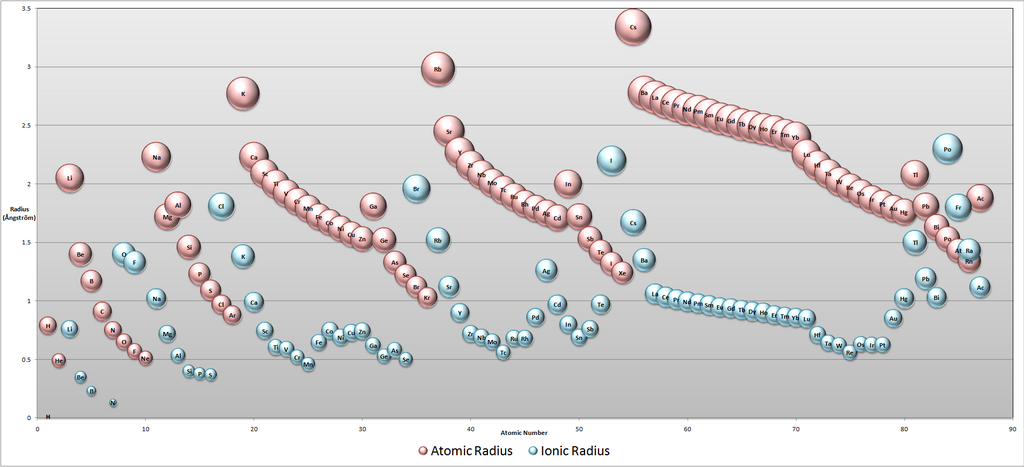
Atomový a iontový poloměr
Atomový poloměr je veličina, která není přesně definována, nejčastěji se odvozuje podle velikosti elektronového obalu atomu. Jeho velikost se pohybuje v rozmezí 28-300 pm. V rámci skupiny se atomové poloměry zvětšují, protože každý další prvek zaplňuje vyšší slupku elektronového obalu. V rámci periody atomové poloměry klesají, hlavním důvodem je vyšší efektivní náboj jádra a tím i silnější přitahování valenčních elektronů.
Iontový poloměr je velikost iontu, kromě protonového čísla, závisí i na náboji. Poloměr kationtů klesá s každým odebraným elektronem, poloměr aniontů naopak s každým přidaným elektronem roste.
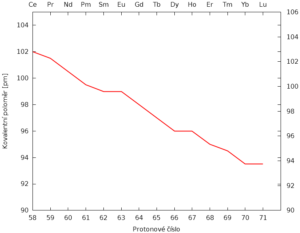
Lanthanoidová a aktinoidová kontrakce
Poloměr lanthanoidů se zmenšuje se zvyšujícím se protonový číslem. Důvody pro tento jev jsou dva:
- Lanthanoidy mají valenční elektrony umístěné v orbitalu 4f, které stíní náboj jádra méně než elektrony v nižších orbitalech. Tím dochází ke zmenšování atomového poloměru, protože jsou silněji přitahovány elektrony z orbitalu 6s.
- Relativistický efekt — u těžkých prvků se vnitřní elektrony dostávají velmi blízko jádra, rychlost se přibližuje k rychlosti světla a poloměr jejich pohybu se zmenšuje.
Lanthanoidovou kontrakci lze pěkně ilustrovat srovnáním iontových poloměrů prvků, ionty lanthanoidů najdeme v rozmezí protonových čísel 57-71.
Elektronegativita
Elektronegativita je schopnost atomu přitahovat si vazebné elektrony. V rámci skupiny klesá se stoupajícím protonovým číslem:
v rámci periody pak elektronegativita stoupá:
Výjimku tvoří prvky d- a f-bloku.
V současnosti se objevují pokusy o změnu definice konceptu elektronegativity, aby byl univerzálnější a použitelný nejen pro atomy.
Ionizační energie
Ionizační energie je energie potřebná pro odtržení elektronu z neutrálního atomu. Hodnota první ionizační energie v rámci skupiny klesá a v rámci periody roste.
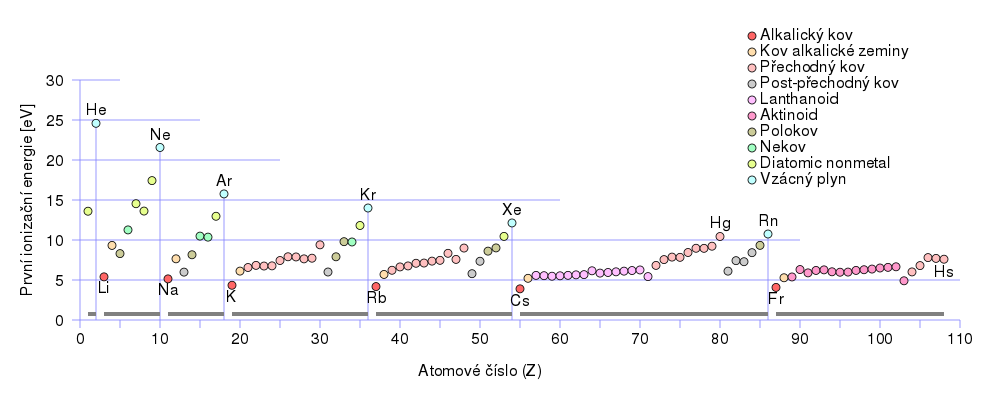
Redoxní vlastnosti
V levé části tabulky jsou redukční činidla (H, Na, Ca, Mg) a v pravé oxidační (F, O, Cl).
Acidobazické vlastnosti
V levé části tabulky jsou zásadotvorné prvky (Na, Ca, Mg) a v pravé kyselinotvorné (F, Cl, S).
Zdroj: Periodicity: Trends in the Periodic Table
Literatura
- KLIKORKA, Jiří a Jaroslav HOLEČEK. Obecná a anorganická chemie: určeno pro posl. Vys. školy chemicko-technologické v Pardubicích. 1. vyd. Praha: Státní nakladatelství technické literatury, 1971, s. 145-384.
- HOUSECROFT, Catherine E a A SHARPE. Anorganická chemie. Vyd. 1. Praha: Vysoká škola chemicko-technologická v Praze, 2014, xxx, 1119 s. ISBN 978-80-7080-872-6.
- Periodic Trends na UCDavis Chemwiki
- Periodická tabulka prvků SCI MUNI
- Slavíček, P., & Muchová, E. (2019). Meze periodické tabulky. Chemické Listy, 113(4), 198–204. Získáno z http://www.chemicke-listy.cz/ojs3/index.php/chemicke-listy/article/view/3334
- Minulost, přítomnost a budoucnost periodické tabulky prvků – prezentace a několik odkazů k mé přednášce na U3V MU
Další kapitoly
- České chemické názvosloví
- Platné číslice a měření
- Základní chemické zákony
- Důležité veličiny a vztahy v chemii
- Výpočet stechiometrického vzorce
- Chemické rovnice a stechiometrické výpočty
- Koncentrace roztoků
- Rozpustnost, součin rozpustnosti
- Stavba atomu
- Periodická tabulka prvků a periodicita vlastností
- Chemická vazba
- VSEPR
- Komplexní sloučeniny
- Magnetické vlastnosti látek
- Termodynamika
- Chemická rovnováha
- Skupenské stavy látek
- Fázové rovnováhy
- Teorie kyselin a zásad
- pH, aktivita roztoku
- Elektrochemie
- Symetrie molekul
- Laboratorní technika
- Lineární regrese
- Jednotky tlaku
- Jednotky teploty
- Mohsova stupnice tvrdosti minerálů
- Odkazy
- Prezentace k semináři z obecné chemie