V tomto článku budeme potřebovat logaritmy, své znalosti tohoto tématu si můžete osvěžit např. na serveru matematika.cz. Také doporučuji pěknou přednášku na youtube.
Aktivita roztoku
Aktivita (a) popisuje reálné chování roztoku. Aktivita jakékoliv čisté látky v jejím standardním je definitoricky jednotková.
μi = μi0 + RT ln ai
μi – chemický potenciál, μi0 – standardní chemický potenciál
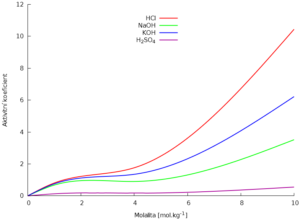
Aktivitu lze vyjádřit jako součin molární koncentrace a aktivitního koeficientu.
a = γc
Aktivitní koeficient popisuje rozdíl mezi ideálním chováním vyjádřeným koncentrací a reálným chováním, které popisuje aktivita. Je úměrný náboji iontů v roztoku a iontové síle roztoku.
log γ = -0,509z2·√I
I – iontová síla roztoku, popisuje množství iontů v roztoku.
$$I = \frac{1}{2}\sum^n_{i=0} c_iz_i^2$$
ci – molalita, zi – náboj, 0,509 – konstanta pro vodné roztoky.
Střední aktivitní koeficienty ve vodných roztocích při 25 °C
| cm[mol.kg-1] | 0,1 | 1,0 | 4,0 | 10,0 |
|---|---|---|---|---|
| HCl | 0,796 | 0,809 | 1,762 | 10,44 |
| NaOH | 0,766 | 0,678 | 0,903 | 3,52 |
| KOH | 0,798 | 0,756 | 1,352 | 6,22 |
| H2SO4 | 0,265 | 0,130 | 0,171 | 0,553 |
| AgNO3 | 0,734 | 0,429 | 0,210 | – |
| Ca(NO3)2 | 0,48 | 0,35 | 0,42 | – |
Zdroj dat: Vohlídal, Jiří. Chemické tabulky. Praha: SNTL, 1982.
pH
pH (Potential of Hydrogen) je číslo, které vyjadřuje, zda daný roztok reaguje kysele, neutrálně nebo zásaditě. Ve vodných roztocích se hodnoty pH pohybují v intervalu od 0 do 14. Pokud má roztok hodnotu pH 7 je neutrální, nižší hodnoty odpovídají kyselému prostředí, vyšší zásaditému.
Hodnota pH je dána koncentrací H+ iontů v roztoku, jde o logaritmickou stupnici, změna koncentrace o jeden řád se projeví změnou hodnoty pH o jedničku.
Kyseliny a zásady
Arrheniova teorie definuje kyseliny jako látky, které ve vodném roztoku uvolňují ionty H+ (H3O+), zásady pak uvolňují OH–.
Brønstedova teorie definuje kyseliny jako donory protonů a zásady jako jejich akceptory.
Lewisova teorie definuje kyseliny jako akceptory elektronových páru a zásady jako jejich donory.
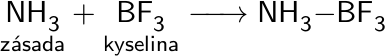
Silné kyseliny a zásady ve vodném roztoku zcela disociují.
HCl + H2O → H3O+ + Cl–
NaOH → Na+ + OH–
Slabé kyseliny a zásady disociují pouze z části. Síla kyseliny a zásady je dána disociační konstantou pKa nebo pKb.
$$K_a = \frac{[H_3O^+][Cl^-]}{[HCl]}$$
$$K_b = \frac{[OH^-][NH_3^+]}{[NH_3]}$$
pKa = -log Ka; pKb = -log Kb
| Kyselina | pKa |
|---|---|
| H3PO4 | pKa1 2,16 pKa2 7,21 pKa3 12,32 |
| Fenol | 10 |
| HClO | 7,53 |
| HF | 3,2 |
| HCl | -7 |
Konjugované páry kyselina-zásada
Konjugované páry jsou dvojice částic vznikající disociací, liší se o H+.
HCl + H2O → H3O+ + Cl–
Konjugovaná zásada k silné kyselině je slabá zásada.
HCl → Cl–
Konjugovaná kyselina k slabé zásadě je silná kyselina.
H2O → H3O+
Autoionizace vody
Voda je amfoterní, tzn. že se chová jako kyselina i jako zásada.
2 H2O → H3O+ + OH–
Iontový součin vody je součin rovnovážné koncentrace iontů. Jeho hodnota je pro dané rozpouštědlo a teplotu konstantní.
KW = [H+][OH–] = 1.10-14 mol.dm-3
pKW = -log KW = 14
Pro konjugovaný pár kyselina-zásada platí:
KaKb = KW
pKa + pKb = pKW
pH a pOH
pH = -log aH3O+ = -log[H3O+]
pOH = -log aOH- = -log[OH–]
pH + pOH = 14,00
Pokud je ph<7, roztok je kyselý, pokud je pH>7, roztok je zásaditý. Neutrální roztok má pH=7.
| pH | pOH | [H+] | [OH–] |
|---|---|---|---|
| 2 | 12 | 0,01 | 10-12 |
| 4 | 10 | 0,0001 | 10-10 |
| 6 | 8 | 10-6 | 10-8 |
| 7 | 7 | 10-7 | 10-7 |
| 8 | 6 | 10-8 | 10-6 |
| 10 | 4 | 10-10 | 0,0001 |
| 12 | 2 | 10-12 | 0,01 |
| 14 | 0 | 10-14 | 1,0 |

Výpočet pH
Silné kyseliny a zásady
Silné kyseliny a zásady jsou v roztoku zcela disociovány. Pro silnou kyselinu platí vztah:
pH = -log[H+]
Pokud se jedná o silnou jednosytnou kyselinu, např. HCl, můžeme vztah zjednodušit:
pH = -log ckys
U silných zásad vycházíme ze vztahu mezi pH a pOH ve vodných roztocích:
pH = 14 – pOH
Pro silnou jednosytnou zásadu, např. NaOH, pak získáme vztah:
pH = -log[H+] = 14 + log czas
Slabé kyseliny a zásady
Slabé kyseliny a zásady jsou v roztoku disociovány pouze částečně. Míru disociace popisuje rovnovážná konstanta:
HA ⇌ H+ + A–
$$\textrm{K = }\frac{[\textrm{H}^+][\textrm{A}^-]}{[\textrm{HA}]}$$
Z rovnice disociace vyplývá, že koncentrace H+ a A– iontů budu stejné. Rovnovážná koncentrace nedisociované kyseliny bude rovna rozdílu výchozí koncentrace a rovnovážné koncentrace H+ iontů. Proto můžeme vztah upravit následovně:
$$\textrm{K = }\frac{[\textrm{H}^+][\textrm{H}^+]}{\textrm{c}_0\ -\ [\textrm{H}^+]} \\
\textrm{K = }\frac{[\textrm{H}^+]^2}{\textrm{c}_0\ -\ [\textrm{H}^+]}$$
Pro slabé kyseliny můžeme zavést i předpoklad, že výchozí koncentrace kyseliny je řádově vyšší než koncentrace iontů, tím získáme zjednodušený vztah, z kterého snadno vyjádříme koncentraci H+:
$$\textrm{K}_\textrm{a}\ =\ \frac{[\textrm{H}^+]^2}{\textrm{c}_0} \\
[\textrm{H}^+] = \sqrt{\textrm{K}_\textrm{a}\ .\ \textrm{c}_0}$$
Logaritmováním tohoto vztahu získáme finální podobu:
$$\textrm{pH = }\frac{1}{2}\textrm{pK}_\textrm{a} – \frac{1}{2}\log \textrm{c}_0$$
Pro zásady musíme využít příslušnou disociační konstantu pKb, vztah pro pH má podobu:
$$\textrm{pH = 14 – }\frac{1}{2}\textrm{pK}_\textrm{b} + \frac{1}{2}\log \textrm{c}_0$$
Hodnoty disociačních konstant můžeme najít v chemických tabulkách, hodnoty pro vybrané kyseliny a zásady jsou uvedeny zde.
Soli silné kyseliny i zásady
NaCl + H2O → Na+ + Cl– + H2O
KNO3 + H2O → K+ + NO3– + H2O
Při disociaci nedochází k ovlivnění koncentrace protonů ani OH–, proto nebude pH roztoku těmito solemi ovlivněno.
Soli slabých kyselin a zásad
Při disociaci solí slabých kyselin dochází ke vzniku iontů H+ nebo OH– a tím i k ovlivnění hodnoty pH.
Sůl slabé zásady a silné kyseliny způsobuje nárůst koncentrace H+ iontů a tím dochází ke snížení hodnoty pH:
NH4NO3 + H2O → NH4+ + NO3– + NH3 + H+
pH = 7 – 1/2(pKb + log c)
Sůl slabé kyseliny a silné zásady způsobuje nárůst koncentrace OH– iontů a tím dochází ke zvýšení hodnoty pH:
NaF + H2O → Na+ + F– + HF + OH–
pH = 7 + 1/2(pKa + log c)
Při disociaci soli slabé kyseliny i zásady dochází ke vzniku iontů H+ i OH–. Poměr disociačních konstant pak určuje, jestli hodnota pH naroste nebo klesne.
NH4F + H2O → NH4+ + F– + NH3 + H+ + HF + OH–
pH = 7 + 1/2(pKa – pKb)
pKa(HF) = 3,17
pKb(NH3) = 4,75
pH = 7 + 1/2(3,17 – 4,75) = 6,21
pH roztoku soli slabé kyseliny a zásady nezávisí na koncentraci, ale pouze na jejich disociačních konstantách.
Pufry, tlumivé (ústojné) roztoky
Jde o roztoky, které se používají pro stabilizaci pH během reakce, příp. měření. Jsou složeny ze slabé kyseliny a její soli, příp. ze slabé zásady a její soli. Příkladem může být acetátový pufr, což je směs kyseliny octové a octanu sodného.
Rovnováhy v tomto pufru můžeme popsat rovnicemi:
CH3COOH + H2O ↔ CH3COO– + H3O+
CH3COONa + H2O ↔ CH3COOH + Na+ + OH–
Přídavkem kyseliny vzniknou molekuly kyseliny octové, přídavkem zásady ionty octanu. pH roztoku se nezmění.
$$pH = pK_a + \log\frac{[A^-]}{[HA]}$$
$$pH = 14 – pK_b + \log\frac{[B^+]}{[BH]}$$
| Pufr | Rozsah pH |
|---|---|
| Acetátový | 3,8 – 5,8 |
| KH2PO4 | 6,2 – 8,2 |
| Borátový | 8,25 – 10,25 |
Výpočet pH slabé kyseliny
Jaké je pH 0,2 M kyseliny octové, pKa = 4,76?
CH3COOH ↔ CH3COO– + H+
Ka = 10-pKa = 10-4,76 = 0,000017
Z rovnice disociace vidíme, že koncentrace octanu a H+ budou stejné.
$$K_a = \frac{[CH_3COO^-][H^+]}{[CH_3COOH]} = \frac{x.x}{0,2-x}$$
Dosadíme za Ka a upravíme získaný výraz, čímž dostaneme kvadratickou rovnici:
x2 + 0,000017x – 0,0000034 = 0
Kvadratickou rovnici vyřešíme pomocí diskriminantu:
$$x_{1,2} = \frac{-b\pm\sqrt{D}}{2a} = \frac{-b\pm\sqrt{b^2-4ac}}{2a} =
\frac{-0,000017\pm\sqrt{0,000017^2-4 \cdot 1 \cdot (-0,0000034)}}{2 \cdot 1}$$
Ze dvou vypočítaných kořenů zvolíme ten kladný, koncentrace totiž nemůže být záporná.
x = 0,0018
pH = -log[H+] = -log0,018 = 2,74
Řešené příklady
Několik řešených příkladů najdete zde.
Další kapitoly
- České chemické názvosloví
- Platné číslice a měření
- Základní chemické zákony
- Důležité veličiny a vztahy v chemii
- Výpočet stechiometrického vzorce
- Chemické rovnice a stechiometrické výpočty
- Koncentrace roztoků
- Rozpustnost, součin rozpustnosti
- Stavba atomu
- Periodická tabulka prvků a periodicita vlastností
- Chemická vazba
- VSEPR
- Komplexní sloučeniny
- Magnetické vlastnosti látek
- Termodynamika
- Chemická rovnováha
- Skupenské stavy látek
- Fázové rovnováhy
- Teorie kyselin a zásad
- pH, aktivita roztoku
- Elektrochemie
- Symetrie molekul
- Laboratorní technika
- Lineární regrese
- Jednotky tlaku
- Jednotky teploty
- Mohsova stupnice tvrdosti minerálů
- Odkazy
- Prezentace k semináři z obecné chemie
One Reply to “pH, aktivita roztoku”