Stechiometrický (empirický) vzorec popisuje poměr jednotlivých prvků ve sloučenině. Uzavírá se do složených závorek. Např. oxid fosforečný má sumární vzorec P4O10, tomu odpovídá stechiometrický vzorec {P2O5}. Stechiometrický vzorec {OH} odpovídá peroxidu vodíku, H2O2. Se stechiometrickým vzorcem se potkáme i v organické chemii, např. benzen (C6H6), má stechiometrický vzorec {CH} nebo butan (C4H10) má stechiometrický vzorec {C2H5}.
Stechiometrický vzorec můžeme snadno vypočítat z výsledků elementární analýzy, která nám poskytne hmotnostní koncentraci prvků.
Pro výpočty budeme potřebovat atomové a molární hmotnosti. Doporučuji využívat některý z online kalkulátorů, např. od firmy Lenntech, existuje ale i spousta jiných aplikací pro Android, které umožní využít mobil nebo tablet.
Příklad 1
Vypočítejte stechiometrický vzorec sloučeniny, která obsahuje 56,58 % K, 8,69 % C a 34,73 % O.
Ze zadání plyne, že hledáme sloučeninu s obecným vzorcem KxCyOz. Platí:
$$K : C : O = x.Ar(K) : y.Ar(C) : z.Ar(O)$$
$$x : y : z = \frac{56,58}{Ar(K)} : \frac{8,69}{Ar(C)} : \frac{34,73}{Ar(O)}$$
$$x : y : z = \frac{56,58}{39,10} : \frac{8,69}{12,01} : \frac{34,73}{16,00}$$
$$x : y : z = 1,45 : 0,72 : 2,17$$
Ve vzorci samozřejmě nemůžeme použít desetinná čísla, proto všechny tři čísla vydělíme nejmenším z nich:
$$x : y : z = 2 : 1 : 3$$
Z toho plyne, že stechiometrický vzorec sloučeniny je {K2CO3} a jedná se tedy nejspíše o uhličitan draselný.
Příklad 2
Vypočítejte hmotností zlomek jednotlivých prvků v dichromanu draselném?
V tomto případě jde o opačný příklad, známe složení látky, ale zajímá nás teoretický výsledek elementární analýzy.
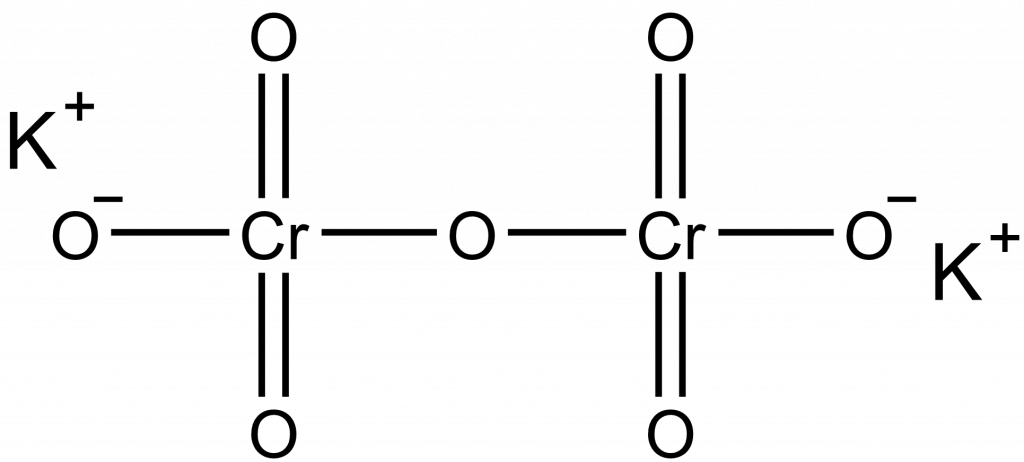
Dichroman draselný má vzorec K2Cr2O7, pro výpočet budeme potřebovat atomové a molární hmotnosti:
| Atom/molekula | Ar/Mr |
| K | 39,10 |
| Cr | 52,00 |
| O | 16,00 |
| K2Cr2O7 | 294,18 |
Výpočet procentuálního zastoupení je jednoduchý, stačí dát do poměru hmotnost prvku (nesmíme zapomenout na zastoupení prvku ve sloučenině) a hmotnost sloučeniny:
$$w(K) = \frac{2 . 39,10}{294,18} = 0,2658 \\
w(Cr) = \frac{2 . 52,00}{294,18} = 0,3535 \\
w(O) = \frac{7 . 16,00}{294,18} = 0,3807$$
Dichroman draselný tedy obsahuje 26,58 % K; 35,35 % Cr a 38,07 5 O. Jako rychlou kontrolu můžeme zkontrolovat součet procent, musí se rovnat 100:
26,58 + 35,35 + 38,07 = 100
Příklad 3
Vypočítejte stechiometrický vzorec sloučeniny se složením: 22,55 % Na; 30,38 % P a 47,07 % O. Jeden mol látky váží 407,85 g, jaký je sumární a strukturní vzorec látky?
První část úkolu je jednoduchá, budeme potřebovat atomové hmotnosti všech tří prvků:
| Na | 22,99 |
| P | 30,97 |
| O | 16,00 |
$$\frac{22,55}{22,99} : \frac{30,38}{30,97} : \frac{47,07}{16,00} \\
0,98 : 0,98 : 2,94 \\
1 : 1 : 3$$
Stechiometrický vzorec je tedy {NaPO3}.
Druhou část úkolu můžeme vyřešit také velmi jednoduše. V zadání je uvedena hmotnost jednoho molu látky, což je molární hmotnost. Potřebujeme tedy zjistit kolikrát se nám hmotnost jednotky NaPO3 vejde do zadané hmotnosti.
M(NaPO3) = 101,96
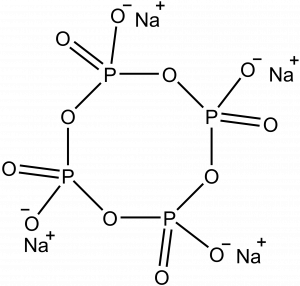
Velmi snadno spočítáme, že látka bude obsahovat čtyři jednotky, její vzorec tedy bude Na4P4O12. Jedná se o cyklo-tetrafosforečnan sodný, jeho strukturní vzorec je na obrázku níže.
Další příklady
Pokud si chcete procvičit výpočty stechiometrického vzorce, můžete zkusit vypočítat těchto pár příkladů.
Další kapitoly
- České chemické názvosloví
- Platné číslice a měření
- Základní chemické zákony
- Důležité veličiny a vztahy v chemii
- Výpočet stechiometrického vzorce
- Chemické rovnice a stechiometrické výpočty
- Koncentrace roztoků
- Rozpustnost, součin rozpustnosti
- Stavba atomu
- Periodická tabulka prvků a periodicita vlastností
- Chemická vazba
- VSEPR
- Komplexní sloučeniny
- Magnetické vlastnosti látek
- Termodynamika
- Chemická rovnováha
- Skupenské stavy látek
- Fázové rovnováhy
- Teorie kyselin a zásad
- pH, aktivita roztoku
- Elektrochemie
- Symetrie molekul
- Laboratorní technika
- Lineární regrese
- Jednotky tlaku
- Jednotky teploty
- Mohsova stupnice tvrdosti minerálů
- Odkazy
- Prezentace k semináři z obecné chemie