K popisu vazby v pevných látkách byl vytvořen tzv. pásový model elektronové struktury tuhých látek. K jeho vzniku přispěli především Bloch, Brllouin, Wigner, Seitz, Kronig a Penney.
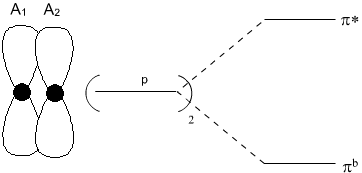
Pro objasnění tohoto modelu vyjdeme z představy překryvu dvou orbitalů p atomů A1 a A2 (obr. 1). Takto vznikne dvojice orbitalů πb a πb. Na obrázku jsou znázorněny energetické hladiny daných orbitalů, za předpokladu, že A1 a A2 jsou atomy téhož prvku. Uvedený překryv vede (pokud je orbital πb obsazený a π* neobsazený) ke vzniku vazby π mezi atomy A1 a A2.
Pokud místo dvou orbitalů, použijeme N orbitalů, kde N je velmi velké číslo, získáme soubor N nových delokalizovaných polycentrických orbitalů, které vytvoří v podstatě souvislý energetický pás (Obr. 2). Rozdíl energií mezi prvním a posledním nově vzniklým orbitalem , je téměř stejný jako u předchozího příkladu.
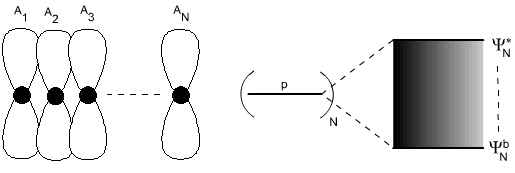
Mezi atomy samozřejmě nedochází pouze k překryvu typu π, ale také σ a popř. i δ. Všechny tyto překryvy mají stejné důsledky jako překryv π, tj. vedou ke vzniku delokalizovaných orbitalů, které z energetického hlediska vytvářejí kvazikontinuální pás.
Krystaly kovů, které nejeví molekulární strukturu, jsou prostorové mřížky vystavěné z atomů. Lze v nich najít atomové řady, podobné těm, kterými jsme se zde zabývali, navíc uspořádané do trojrozměrného prostoru.
Výsledkem složitého způsobu překryvu v prostorově uspořádané mřížce kovu je vždy přeměna původních valenčních atomových orbitalů na energetický pás vystavěný z velkého množství nových delokalizovaých orbitalů. Tyto pásy představují svým horním a dolním okrajem rozmezí energií, jakých může nabývat elektron, který se v pásu vyskytuje. Nazývají se proto dovolené pásy. Oblasti energií mezi těmito pásy se označují jako zakázané pásy. Energetická šíře těchto pásů, především však pásů zakázaných, má zásadní význam při objasňování některých vlastností pevných látek.
Dovolené pásy se skládají ze tří druhů atomových orbitalů (AO):
AO ležící po valenční sférou každého atomu jsou v základním stavu atomu plně obsazeny elektrony. Uspořádáním atomů do mřížky jsou ovlivněny minimálně a zůstávají beze změny energie lokalizovány na jednotlivých atomech.
AO valenční sféry atomu se hluboko vzájemně prolínají a mění se na soubory delokalizovaných orbitalů, vyplňujících poměrně široké energetické pásy. Způsob obsazení těchto pásů elektrony určuje mnoho vlastností vzniklé mřížky.
AO vyšších kvantových čísel také vzájemně hluboce interagují. Poněvadž mají vysokou energii nejsou obsazeny elektrony a nemají vliv na vlastnosti souboru atomů.
Uspořádání elektronů v energetických pásech tuhých látek
Obsazování dovolených energetických pásů v tuhých látkách se řídí týmiž principy jako obsazování lokalizovaných orbitalů v molekulách.
- Elektrony zaplňují jednotlivé hladiny v pásu tak, aby měly co nejmenší energii.
- Při zaplňování pásu elektrony se uplatňuje Pauliho princip. Do dovoleného pásu o N hladinách může být umístěno maximálně 2N elektronů.
- Teprve po úplném obsazení energeticky nižšího pásu obsazují elektrony pás s vyšší energií.
Je samozřejmé, že uvedené zásady platí jen tehdy, když v dané soustavě atomů nedochází k velkému tepelnému pohybu nebo když nepůsobí jiné fyzikální vlivy vyvolávajícíc excitaci přítomných elektronů. Tohoto stavu můžeme dosáhnout při teplotě 0 K, pokud zabráníme styku látky s elektromagnetickým zářením.
Je-li celý systém elektronů tuhé látky na nejnižších možných hladinách, nabývá zvláštního významu nejvyšší energetická hladina v dovoleném pásu, která je právě ještě zaplněna dvojicí elektronů. Nazývá se Fermiho hladina a podle jejího umístění v dovoleném energetickém pásu při teplotě 0 K můžeme posuzovat některé fyzikální vlastnosti a povahu vazby v daném souboru atomů:
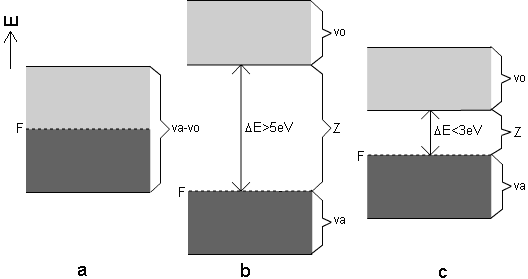
Jestliže Fermiho hladina při teplotě 0 K leží uvnitř dovoleného pásu – nebo-li, pokud postačuje počet elektronů přítomných v soustavě atomů jen k částečnému zaplnění dovoleného pásu, vytváří se při velmi nízkých teplotách takové uspořádání elektronů, jaké je zachyceno na obr. 3a. Tato elektronová konfigurace je charakteristická pro elementární kovy, slitiny, intermetalické sloučeniny a další tuhé látky, které mají výbornou elektrickou vodivost. Částečně zaplněný pás a relativní snížení energie valenčních elektronů, které se v pásu vyskytují je příčinou vzniku vysoce delokalizované kovové vazby, poutající celý soubor atomů v poměrně velmi pevný celek. Pás takto obsazený elektrony bývá označován jako pás vodivostně-valenční.
Jiná situace nastává, když Fermiho hladina při teplotě 0 K leží na horním okraji dovoleného pásu. Pás je pak elektrony právě zcela naplněn (obr. 3b). V takovémto pásu nejsou elektrony volně pohyblivé, mřížka není eletricky vodivá. Snížení energie elektronů umístěných do pásu je příčinou vazebné soudržnosti atomů. Takto obsazený pás se nazývá valenční.
Pokud je energetický rozdíl mezi horním okrajem valenčního pásu a dolním okrajem nejbližšího energeticky vyššího prázdného dovoleného pásu větší než 5 eV, pak ani značný tepelný pohyb v mřížce nedokáže excitovat elektrony z valenčního do prázdného pásu. Materiál s takto uspořádanými pásy je izolant a to i za vysokých teplot. I v tomto případě se neobsazený dovolený pás nazývá pás vodivostní a energetický interval mezi jeho dolním okrajem a Fermiho hladinou se označuje jako šířka zakázaného pásu.
Jestliže stejně jako v předchozím případě Fermiho hladina splývá při teplotě 0 K s horním okrajem valenčního pásu, avšak vodivostní pás je vzdálen méně než 3 eV, dochází vlivem tepelného pohybu, příp. jiné excitace k přechodu elektronů z valenčního pásu do pásu vodivostního. Takovéto materiály se nazývají polovodiče.
Literatura
- J. KLIKORKA a kol.: Obecná a anorganická chemie, SNTL Praha, 1985.
- C. E. HOUSECROFT, A. G. SHARPE: Anorganická chemie, VŠCHT Praha, 2014.
- Band Theory of Solids
One Reply to “Pásová teorie pevných látek”