Fluor, F, je nekovový plyn, žlutozelené barvy. Je značně reaktivní a extrémně korozivní, kvůli problémům s transportem se nejčastěji spotřebovává na místě výroby. Čistý fluor byl připraven až roku 1886 elektrolýzou roztoku KHF2 v HF. Fluor a sloučeniny fluoru leptají sklo, proto se s nimi pracuje v plastových aparaturách.
| Atomové číslo | 9 | Počet stabilních izotopů | 1 |
| Atomová hmotnost | 18,998403 | Elektronová konfigurace | [He] 2s2 2p5 |
| Teplota tání [°C] | -218,62 | Teplota varu [°C] | -188,12 |
| Elektronegativita | 3,98 | Hustota [kg.m-3] | 1,696 |
Izotopy
Přírodní fluor se skládá ze stabilního izotopu 19F a stopových množství radioizotopu 18F. Celkem známe 17 radioizotopů fluoru.
18F
Tento izotop má nejdelší poločas přeměny ze všech radioizotopů fluoru, 109,73 minut. Mechanismem β+ se mění na 18O:
$$^{19}_{\ \ 9}\textrm{F }\rightarrow\ ^{19}_{\ \ 8}\textrm{O + }^0_1\textrm{n}$$
Je to nejlehčí izotop, který obsahuje stejný a lichý počet neutronů a protonů.
Výskyt a výroba
Fluor je třináctý nejrozšířenější prvek v zemské kůře, kde se vyskytuje nejčastěji v kazivci (CaF2), kryolitu (Na3[AlF6]) a fluoroapatitu (Ca5(PO4)3F). Asi nejvíce využívaná sloučenina fluoru je kyselina fluorovodíková HF a také kryolit Na3[AlF6], který se používá při elektrolytické výrobě hliníku.
Průmyslová výroba větších množství fluoru se provádí elektrolýzou směsi KF/HF. Vodíkové a fluoridové ionty jsou redukovány a oxidovány za vzniku vodíku a fluoru. Elektrolýza probíhá při teplotě 70-130 °C. KF má roli katalyzátoru, samotný HF nelze elektrolyzovat.[14]
Menší množství fluoru lze připravit reakcí manganistanu draselného s fluoridem draselným v prostředí kyseliny fluorovodíkové a následným rozkladem produktu pomocí silně Lewisovsky kyselého fluoridu antimoničného.[15]
2 KMnO4 + 2 KF + 10 HF + 3 H2O2 → 2 K2MnF6 + 8 H2O + 3 O2↑
2 K2MnF6 + 4 SbF5 → 4 KSbF6 + 2 MnF3 + F2↑
Chemické vlastnosti
Chemie fluoru je velice bohatá a rozsáhlá. Fluor je velmi reaktivní prvek a reaguje prakticky se všemi prvk s výjimkou helia, argonu a neonu. S většinou prvků reaguje i za nízkých teplot a zpravidla velmi prudce, až explozivně.
Anorganické sloučeniny
Binární fluoridy známe v široké paletě stechiometrických poměrů od C4F až po IF7 (XeF8 ?). Fluoridy se často používají jako fluorační činidla, jako náhrada elementárního fluoru, který je drahý a velmi špatně se s ním pracuje. Fluorační síla klesá v řadě: ClF3 > BrF5 > IF7 > ClF > BrF3 >IF5.
Mimo fluoridů tvoří fluor i bifluoridový anion, HF2–. Struktura aniontu je lineární, [F-H-F]–, patří do bodové grupy symetrie D∞h.[18]
Sloučeniny se vzácnými plyny
Vzácné plyny netvoří příliš mnoho sloučenin, většina jich obsahuje právě fluor. První připravenou sloučeninou vzácného plynu byl Xe[PtF6].[16]
Organické sloučeniny
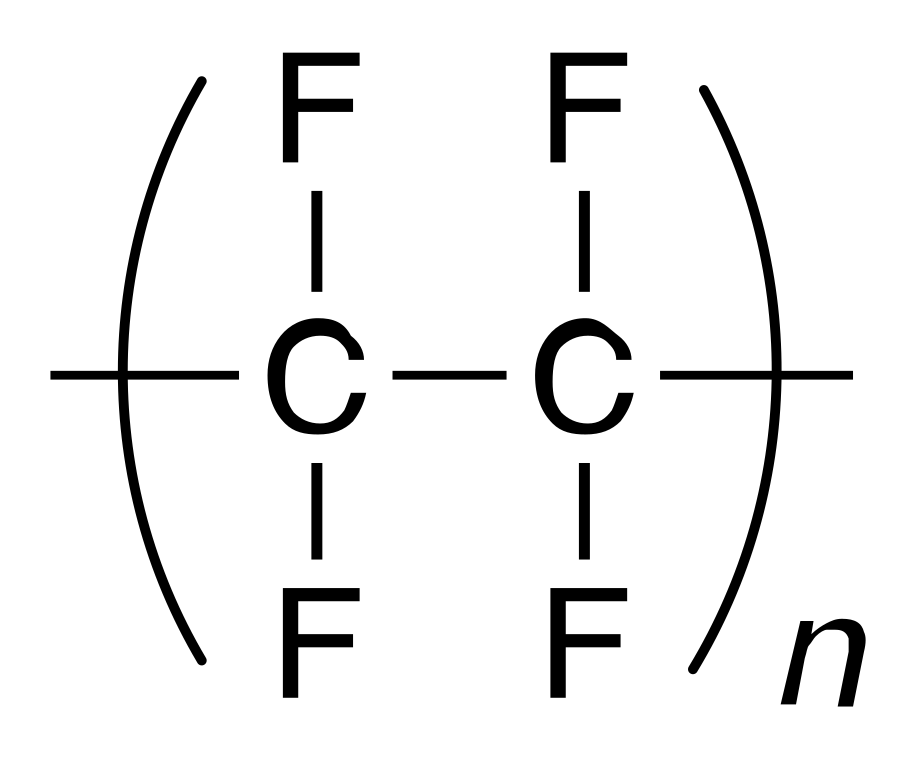
V praxi se často setkáváme s teflonem, což je polymer obsahující fluor – polytetrafluorethylen. Využívá se jak při výrobě kuchyňského nádobí, tak u vysoce odolných chemických aparatur.
NMR
Fluor je monoizotopický prvek, citlivost v NMR se blíží citlivosti 1H. Poskytuje úzké signály, rozsah chemických posunů je poměrně široký.
| 19F | |
|---|---|
| Spin | 1/2 |
| Zastoupení v přírodě [%] | 100 |
| Citlivost vzhledem k 1H | 0,834 |
| Citlivost vzhledem k 13C | 4716 |
| Rezonanční frekvence v poli 1 T | 40,0776 |
| Rozsah chemických posunů | 700 ppm; -300 až 400 ppm |
19F chemické posuny
| Sloučenina | Posun [ppm] | Sloučenina | Posun [ppm] |
| XeF4 | 438 | CF2 | -40-(-120) |
| F2 | 423 | C=C-F | -50-(-220) |
| XeF2 | 258 | ArF | -100-(-200) |
| NF3 | 147 | R-F | -120-(-260) |
| C=N-F | 140-(-70) | BF3 | -124 |
| O=C-F | 60-20 | C6F6 | -163 |
| HF | 40 | MeF | -270 |
Anorganické fluoridy ve vodném prostředí vytvářejí komplexní anionty jejichž složení a chemický posun závisí na koncentraci. Proto nejsou příliš vhodné pro kalibraci spektrometru.
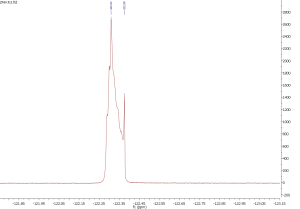
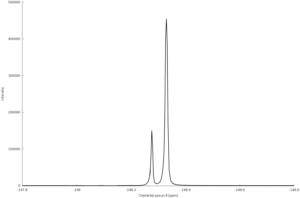
Spektra izotopologů BF4−
Izotopology jsou sloučeniny, které se liší izotopovým složením, toto má pochopitelně vliv i na vzhled NMR spekter. Protože se přírodní bor skládá ze dvou izotopů 10B a 11B, které se vyskytují v zastoupení 20:80, tak i anion BF4− nacházíme ve formě dvou izotopologů: 10BF4− (20 %) a 11BF4− (80 %). V 19F spektrech pak nacházíme dva signály s odpovídajícím integrálním poměrem intenzit.[17]
Odkazy
- V přírodě byl nalezen elementární fluor
- Fluorid bromný – BrF
- The rate of the F + H2 reaction at very low temperatures
- Fluor na české wikipedii
- Fluor na anglické wikipedii
- 19F NMR
- The 19F NMR shifts are not a measure for the nakedness of the fluoride anion
- 19F-NMR solid state investigations of monovalent alkali metal fluorides and tetra-alkylammonium fluorides
- Fluorine-19 magic-angle spinning NMR
- Applications of 19F multidimensional NMR
- Comparison of 1H–19F two-dimensional NMR scalar coupling correlation pulse sequences
- 19F DOSY NMR analysis for spin systems with nJFF couplings
- 19F NMR Fingerprints: Identification of Neutral Organic Compounds in a Molecular Container
- Accounting for Fluorine: Production, Use, and Loss
- Chemical synthesis of elemental fluorine
- Xe[PtF6]
- Boron Isotope Effects in Fluorine NMR Spectra
- Bifluoride
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
5 Replies to “Fluor”