Dusík, N, je za normální teploty plyn bez barvy a zápachu. Má dva stabilní izotopy – 14N a 15N a dva umělé – 13N a 16N.[7] Oba stabilní izotopy jsou důležité v NMR spektroskopii. Dusík je velmi nereaktivní plyn, čehož se využívá např. při práci s látkami citlivými na kyslík a vzdušnou vlhkost. Za laboratorní teploty reaguje pouze s lithiem[2] a plutoniem.[3]
| Atomové číslo | 7 | Počet stabilních izotopů | 2 |
| Atomová hmotnost | 14,0067 | Elektronová konfigurace | [He] 2s2 2p3 |
| Teplota tání [°C] | -210,01 | Teplota varu [°C] | -195,80 |
| Elektronegativita | 3,1 | Hustota [kg.m-3] | 1,2506 |
Za vysokého tlaku vytváří dusík pevný 2D materiál.
Dusík se získává frakční destilací zkapalněného vzduchu. V menším měřítku je možné jej získat pomocí speciálních selektivních membrán, které dokáží dusík separovat od ostatních složek vzduchu. Příp. využít vhodnou reakci, asi nejpoužívanější jsou termický rozklad azidu sodného nebo dusičnanu, příp. dusitanu amonného.
2 NaN3 (s) → 2 Na + 3 N2
NH4NO2(aq) → N2 + 2 H2O
2 NH4NO3(s) → 2 N2 + 2 O2 + 4 H2O
Izotopy
Přírodní dusík se skládá ze dvou stabilních izotopů a stopového množství radioizotopu 13N.
| Izotop | Poločas rozpadu | Zastoupení [%] |
| 13N | 9,965 minut | stopy |
| 14N | stabilní | 99,6 |
| 15N | stabilní | 0,4 |
9N
V roce 2023 byl pozorován exotický izotop 9N, který obsahuje 7 protonů a pouze dva neutrony. Tento izotop byl zachycen v rozpadové řadě izotopu 13O, jeho poločas rozpadu je méně než 1 attosekunda (1 as = 1.10-18 s). Rozpadá se za vzniku jádra 4He a uvolnění pěti protonů.[9]
$$^9_7\textrm{N}\ \rightarrow\ ^4_2\textrm{He}\ +\ 5\ ^1_1\textrm{p}$$
13N
Tento izotop v přírodě vzniká interakcí gamma záření s neutrony jader 14N a 16O:
$$^{14}_{\ \ 7}\textrm{N}\ +\ \gamma\ \rightarrow\ ^{13}_{\ \ 7}\textrm{N}\ +\ ^1_0\textrm{n} \\
^{16}_{\ \ 8}\textrm{O}\ +\ \gamma\ \rightarrow\ ^{15}_{\ \ 8}\textrm{O}\ +\ ^1_0\textrm{n}$$
Poločas přeměny je 9,965 minut, uměle se připravuje ostřelováním vody urychlenými protony:
$$^{16}_{\ \ 8}\textrm{O}\ +\ ^1_1\textrm{p}\ \rightarrow\ ^{13}_{\ \ 7}\textrm{N}\ +\ ^4_2\textrm{He}$$
Využívá se v lékařské diagnostice, ve formě značené molekuly dusíku nebo amoniaku, k vyšetřování dýchacích cest a prokrvení tkání.
16N
Poločas rozpadu 7,13 s. Vyrábí se ostřelováním kyslíku 16O rychlými neutrony.
$$^{16}_{\ \ 8}\textrm{O}\ +\ ^1_0\textrm{n}\ \rightarrow\ ^{16}_{\ \ 7}\textrm{N}\ +\ ^1_1\textrm{p}$$
Měření aktivity 16N v chladící vodě se využívá k regulaci výkonu některých jaderných reaktorů.
Sloučeniny
Amoniak
Amoniak nebo azan (NH3) je jednou z průmyslově nejdůležitějších sloučenin dusíku, více informací najdete na samostatné stránce.
Oxidy
Známe nejméně sedm binárních sloučenin dusíku s kyslíkem:
- Oxid dusný – N2O
- Oxid dusnatý – NO
- Oxid dusitý – N2O3 ≡ NO.NO2
- Oxid dusičitý – NO2
- Oxid dusičný – N2O5
- Nitrosylazid – N4O
- Trinitramid – N4O6 ≡ N(NO2)3
Hexazin
Hexazin je dusíkový analog benzenu, kde jsou všechny uhlíky nahrazeny atomy dusíku. Zatím (2024) nebyl připraven, ale v roce 2022 byla publikována příprava antiaromatického aniontu [N6]2- a v roce 2023 příprava aromatického aniontu [N6]4-.
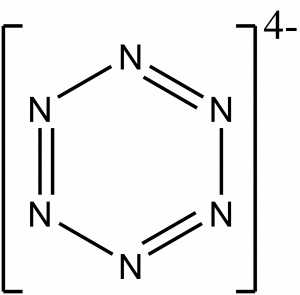
Anion [N6]2- byl připraven působením vysokého tlaku (>45 GPa) na azid draselný (KN3) v diamantové kovadlině za ohřevu laserem na teplotu cca 2200 °C.[10]
NMR
14N NMR
Jádro 14N je kvadrupól, tzn. že signály jsou rozšířené. To značně ztěžuje měření, zvláště u nesymetrických molekul, výhodou je ale vysoké zastoupení tohoto izotopu v přírodě.
| Spin | 1 |
|---|---|
| Zastoupení v přírodě | 99,63 % |
| Jaderný magnetický moment | +0,4037610 |
| Rozsah chemických posunů | 0 až 900 ppm |
| Relativní citlivost k 1H | 1,01×10-3 |
| Relativní citlivost k 13C | 5,74 |
Jádro 14N může způsobit rozšíření signálů jader v jeho okolí, tomu lze předejít dekaplováním během měření.[5]
15N NMR
15N NMR poskytuje podstatně užší linie, ale pokud nemáme obohacené vzorky, tak je nutné měřit pomocí technik INEPT nebo HSQC, příp. HMBC. Kvůli minimálnímu zastoupení izotopu v přírodním dusíku je citlivost velice nízká.
| Spin | 1/2 |
|---|---|
| Zastoupení v přírodě | 0,368 % |
| Jaderný magnetický moment | -0,2831888 |
| Rozsah chemických posunů | -300 až 900 ppm |
| Relativní citlivost k 1H | 3,85×10-6 |
| Relativní citlivost k 13C | 0,0219 |
Odkazy
- Dusík na české wikipedii
- Dusík na anglické wikipedii
- Surface and Corrosion Chemistry of Plutonium
- Nitrogen NMR
- 15N NMR Spectroscopy in Structural Analysis: An Update (2001 – 2005)
- Improved 1H Resolution with 14N Decoupling
- HÁLA, Jiří. Radioaktivní izotopy. Tišnov: Sursum, 2013. ISBN 978-80-7323-248-1.
- Catalytic N2-to-NH3 (or -N2H4) Conversion by Well-Defined Molecular Coordination Complexes
- Strong Evidence for 9N and the Limits of Existence of Atomic Nuclei
- Stabilization of hexazine rings in potassium polynitride at high pressure
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
18 Replies to “Dusík”