Thallium je bílý, měkký, silně toxický kov. V periodickém systému ho najdeme v 13. skupině v 6. periodě. Patří tedy mezi triely. Získává se popílků ze sulfidického pražení při výrobě kyseliny sírové a při tavení rud zinku a olova. Jeho využití není velké, světová produkce činí cca 10 t/rok. Sloučeniny thallia se využívají např. při konstrukci detektorů infračerveného záření.
| Atomové číslo | 81 | Počet stabilních izotopů | 2 |
|---|---|---|---|
| Atomová hmotnost | 204,383 | Elektronová konfigurace | [Xe] 4f14 5d10 6s2 6p1 |
| Teplota tání [°C] | 303,5 | Teplota varu [°C] | 1457 |
| Hustota | 11,85 | Elektronegativita | 1,8 |

Výskyt a výroba
Thallium bylo objeveno roku 1861 pomocí plamenové fotometrie, pojmenováno bylo podle zelené emisní čáry. Objevili jej nezávisle na sobě W. Crookes a C.A. Lamy. Nacházíme jej ve třech minerálech – crookesitu (TlCu7Se4), hutchinsonitu (TlPbAs5S9) a loránditu (TlAsS2). Z těchto minerálů se však nezískává, hlavním zdrojem jsou popílky po pražení sulfidických rud při výrobě kyseliny sírové.
Izotopy
Thallium má dva stabilní izotopy – 203Tl a 205Tl, dále známe 39 radioizotopů.
| Izotop | Zastoupení [%] |
| 203Tl | 29,5 |
| 205Tl | 70,5 |
Nejdelší poločas rozpadu má 204Tl – 3,78 roku.
201Tl
201Tl má poločas přeměny 72,91 hodin, elektronovým záchytem se přeměňuje na 201Hg.
Připravuje se ozařováním 203Tl protony a následnou přeměnou 201Pb.[4,5]
$$^{203}_{\ \ 81}\textrm{Tl}\ +\ ^1_1\textrm{p}\ \rightarrow\ ^{201}_{\ \ 82}\textrm{Pb}\ +\ 3\ ^1_0\textrm{n} \\
^{201}_{\ \ 82}\textrm{Pb}\ \rightarrow\ ^{201}_{\ \ 81}\textrm{Tl}\ +\ ^0_1\textrm{e}^+$$
Roztok 201TlCl se využívá v nukleární medicíně pro zobrazení prokrvení srdce, metoda je založena na podobném chování thallného a draselného iontu.[8] Jelikož se draselné ionty kumulují v srdečním svalu, chovají se podobně i ionty thallné.
Využití
V minulosti se sloučeniny thallia používaly jako jedy na mravence a krysy, ale v současnosti se od nich již upustilo.

Směsné halogenidy thallné se používají jako optická skla pro infračervenou spektroskopii (KRS-5, KRS-6), jsou dobře propustná pro IR záření a nerozpustná ve vodě.
Thallné sloučeniny jsou silně toxické, jako protijed se využívá berlínská modř, KFe[Fe(CN)6]. Ta funguje jako iontoměnič, má větší afinitu k iontům Tl+ než K+ a dokáže je proto z organismu odstranit.
Chemické vlastnosti
Při styku se vzduchem se thallium oxiduje, tomu lze zabránit skladováním v oleji. V přítomnosti vody vytváří hydroxid. V kyselině chlorovodíkové se pasivuje, díky vzniku nerozpustné chloridu thallného, ale v sírové a dusičné kyselině se rozpouští za vzniku příslušných solí.
Sloučeniny thallné (oxidační stav I) jsou stabilní, naproti tomu sloučeniny thallité (III) jsou (vlivem inertního elektronového páru 6s2) středně silné oxidační činidla.
Hydridy
Thallan, TlH3, nebyl dosud připraven v makroskopickém množství. Zatím byl připraven pouze pomocí matricové izolace.[7] Kovové thallium bylo převedeno do plynné fáze laserovou ablací a deponováno společně s vodíkem, příp. deuteriem (2H) do matrice tvořené neonem a argonem. Pomocí infračervené spektroskopie byly identifikovány pásy odpovídající sloučeninám TlH, TlH2 a TlH3.
Oxidy
Oxid thallný, Tl2O, je hygroskopický, s vodou reaguje za vzniku silného hydroxidu thallného, TlOH. Dehydratací hydroxidu v suché atmosféře lze získat zpět oxid:
2 TlOH → Tl2O + H2O
Oxid thallitý, Tl2O3, má kovové vlastnosti a vykazuje vysokou vodivost. Lze ho připravit pomocí MOCVD směsi acetylacetonátu thallného a kyslíku.[9] V přírodě se vyskytuje jako vzácný minerál avicennit.[10]
Halogenidy
Halogenidy thallité jsou méně stabilní než trihalogenidy lehčích prvků 13. skupiny.
Fluorid thallitý, TlF3, je pevná látka s teplotou tání 550 °C, ve vodném roztoku hydrolyzuje:
TlF3 + 3 H2O → Tl(OH)3 + 3 HF
Chlorid thallitý, TlCl3, je nestabilní a při 40 °C uvolňuje chlor za vzniku TlCl.
Bromid thallitý, TlBr3, se rozkládá při ještě nižší teplotách.
Jodid thallitý není dosud znám, sloučenina se vzorcem TlI3 je trijodid thallný. Aniontem je trijodid, lineární ion I3–.
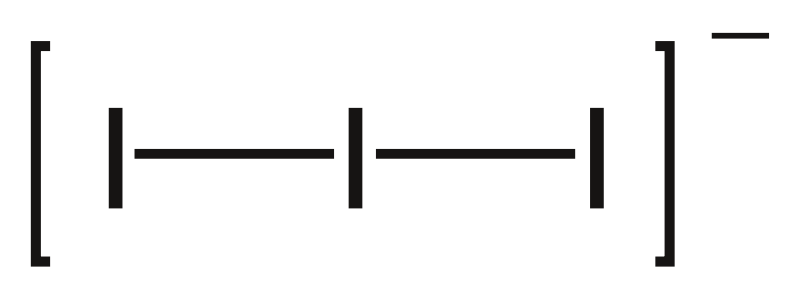
Fluorid thallný, TlF, je krystalická látka s teplotou tání 322 °C, dobře rozpustná ve vodě. Můžeme jej připravit reakcí uhličitanu s kyselinou fluorovodíkovou:
Tl2CO3 + 2 HF → 2 TlF + CO2 + H2O
Chlorid thallný, TlCl, je bílá krystalická látka, citlivá na světlo.
Bromid thallný, TlBr, je žlutá krystalická látka, citlivá na světlo.
Jodid thallný, TlI, je žlutá krystalická látka, při 175 °C přechází na metastabilní červenou modifikaci.
Směsné halogenidy thallné (bromojodidy a bromochloridy) se označují jako KRS a využívají se v IR spektroskopii jako optické prvky.

Supravodivost
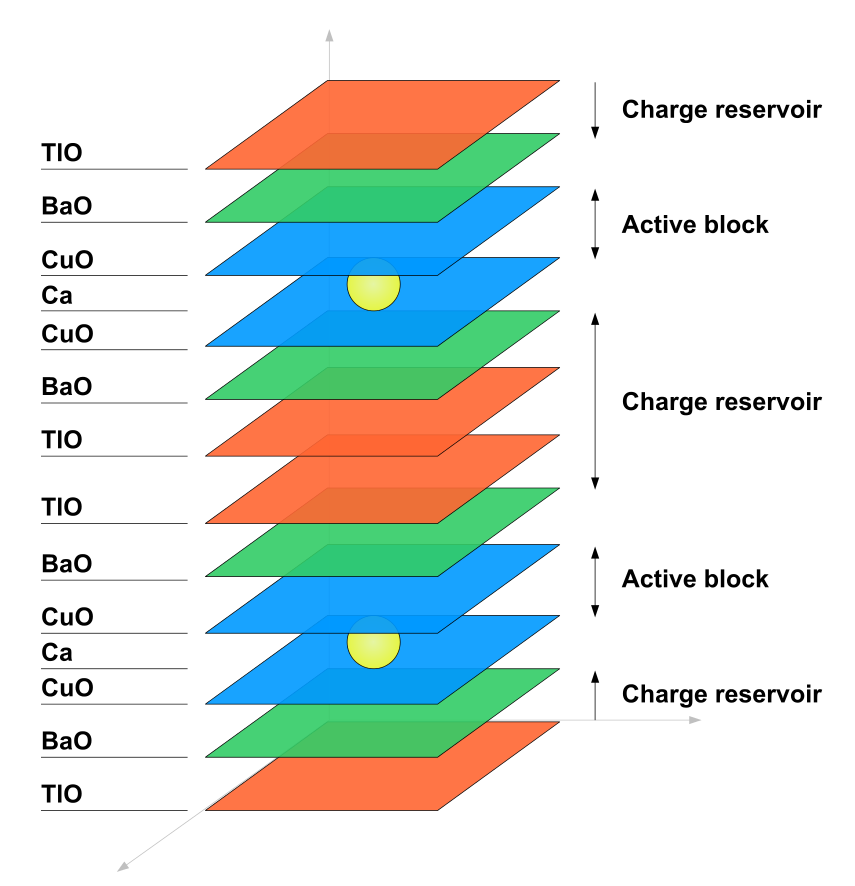
Kovové thallium je supravodivé pod teplotou 2,38 K. Thallium je součástí některých vysokoteplotních supravodičů, např. TBCCO. Jejich obecný vzorec je TlmBa2Can-1CunO2n+m+2.[6]
NMR
Přírodní thallium je tvořen směsí dvou velmi citlivých izotopů se spinem 1/2. Standardem je TlNO3. 205Tl NMR se využívá pro NMR studium biologických systémů, které obsahují Na a K. Chování thallných iontů je totiž velmi podobné chování iontů draselných a sodných.
| 203Tl | 205Tl | |
|---|---|---|
| Spin | 1/2 | 1/2 |
| Zastoupení v přírodě [%] | 29,524 | 70,476 |
| Citlivost vzhledem k 1H | 0,0578 | 0,142 |
| Citlivost vzhledem k 13C | 331 | 813 |
| Rezonanční frekvence v poli 1 T | 24,7316 | 24,9749 |
| Jaderný magnetický moment | +1,6222579 | +1,6382146 |
Chemické posuny
| Látka | Rozpouštědlo | Posun [ppm] |
|---|---|---|
| Me3Tl | pentan | 5093 |
| Et3Tl | pentan | 4693 |
| Ph3Tl | ether | 3814 |
| Me2TlNO3 | n-butylamin | 3586 |
| Me2TlNO3 | voda | 3514 |
| Me2TlNO3 | formamid | 3477 |
| Me2TlNO3 | DMSO | 3450 |
| Me2TlNO3 | DMF | 3386 |
| Me2TlNO3 | HMPA | 3346 |
| PhTlCl2 | pyridin | 3087 |
| PhTlCl2 | methanol | 2989 |
| TlCl3 | pevný | 2220 |
| TlCl3 | tavenina | 2515 |
| TlCl3 | voda | 2307 |
| TlF | pevný | 1300 |
| TlF | tavenina | 1380 |
| TlCl | pevný | 325 |
| TlCl | tavenina | 1250 |
| TlBr | pevný | 1100 |
| TlBr | tavenina | 1620 |
| TlNO3 | voda | 0 |
Interakční konstanty
| Sloučenina | Interakční konstanty [Hz] |
|---|---|
| Me3Tl | 2JTl-H = -268,8 |
| 1JTl-C = 1930 | |
| Et3Tl | 2JTl-H = -198,2 |
| 3JTl-H = 396,1 | |
| Me2TlN(SiMe3)2 | 3JTl-H = -324 |
| Me2TlOAc2 | 2JTl-H = -408 |
| 3JTl-C = 2513 | |
| TlH4– | 1JTl-H = 6144 |
| (TlOEt)4 | 2JTl-Tl = 2560 |
| Sn8Tl5- | 1JTl-119Sn = 795 |
| 1JTl-117Sn = 760 | |
| P2(TlMe2)2(Ph)4 | 1JTl-P = 3203 |
| P2(TlMe2)2(Ph)4 | 1JTl-P = 3203 |
| Tl(I)/2,2,2-cryptand | 1JTl-15N = 850 |
| Tl(I)/valinomycin | 1JTl-13C = 96 |
Odkazy
- Thallium na české wikipedii
- Thallium na anglické wikipedii
- Thallium NMR Spectroscopy, J. F. Hinton; Bull. Magn. Reson., 13 (3-4) 90-108 (1992)
- HÁLA, Jiří. Radioaktivní izotopy. Tišnov: Sursum, 2013. ISBN 978-80-7323-248-1.
- Isotopes of thallium
- Bulk superconductivity at 120 K in the Tl–Ca/Ba–Cu–O system
- Infrared Spectra of Thallium Hydrides in Solid Neon, Hydrogen, and Argon
- Non-invasive diagnosis of coronary artery disease by 123I-BMIPP/201TlCl dual myocardial SPECT in patients with heart failure
- Growth and characterization of thin films of thallium(III) oxide by organometallic chemical vapor deposition
- Avicennite
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |