Titan objevil v roce 1791 farář a amatérský chemik William Gregor v minerálu ilmenitu. Izolován v čistém stavu byl až v roce 1910 redukcí TiCl4 pomocí sodíku. Patří mezi hojně rozšířené prvky v zemské kůře, jeho obsah je cca 0,63 %. Kovový titan má dobré mechanické vlastnosti při malé hustotě, zároveň je i odolný vůči korozi, toho se využívá v letectví a také při výrobě námořních zařízení.
| Atomové číslo | 22 | Počet přírodních izotopů | 5 |
|---|---|---|---|
| Atomová hmotnost | 47,88 | Elektronová konfigurace | [Ar] 3d2 4s2 |
| Teplota tání [°C] | 1667 | Teplota varu [°C] | 3285 |
| Hustota | 4,50 |
Izotopy
Titan má pět stabilních izotopů a dále známe 21 radioizotopů. Nejdelší poločas přeměny má 44Ti, záchytem elektronu se přeměňuje na 44Sc s poločasem přeměny 59,1 let.[9]
| Izotop | Zastoupení [%] | Poločas přeměny |
| 44Ti | umělý | 59,1 roku |
| 45Ti | umělý | 3,08 hodiny |
| 45Ti | 8,25 | stabilní |
| 47Ti | 7,44 | stabilní |
| 48Ti | 73,72 | stabilní |
| 49Ti | 5,41 | stabilní |
| 50Ti | 5,18 | stabilní |
44Ti
Radioizotop 44Ti vzniká nukleosyntézou ve hvězdách a během exploze supernov.[10] Jeho přeměna může probíhat pouze záchytem elektronu, proto je poločas přeměny závislý i na stupni ionizace. Jádro 44Ti bez elektronů, tzn. 44Ti22+, by mělo být teoreticky stabilní.
$$^{44}_{22}\textrm{Ti }\rightarrow\ ^{44}_{21}\textrm{Sc}$$
45Ti
Mechanismem β+ se mění na 45Sc, poločas přeměny je lehce přes 3 hodiny.
$$^{45}_{22}\textrm{Ti }\rightarrow\ ^{45}_{21}\textrm{Sc + } ^0_1\beta^+$$
Výroba
Výroba je založena na redukci ilmenitu (FeTiO3) nebo rutilu (TiO2) uhlíkem v proudu chloru za vysoké teploty. Následně se vzniklý TiCl4 redukuje hořčíkem na kovový titan.
2 FeTiO3 + 7 Cl2 + 6 C → 2 TiCl4 + 2 FeCl3 + 6 CO
TiO2 + 2 Cl2 + 2 C → TiCl4 + 2 CO
TiCl4 + 2 Mg → Ti + MgCl2
Tímto postupem vzniká tzv. titanová houba, která je následně očištěna v lučavce královské, rozdrcena a přetavena na ingoty.
Chemické vlastnosti
Podobně jako hořčík nebo hliník se titan pasivuje vznikem oxidu na povrchu. Podobně se chová i v atmosféře dusíku, kdy vzniká povrchová vrstva nitridu, za vyšší teploty v dusíkové atmosféře i hoří. Nereaguje s bázemi, ani za zvýšené teploty a nerozpouští se v minerálních kyselinách za pokojové teploty. S horkou HCl reaguje na TiCl3 za uvolňování vodíku. S kyselinou dusičnou reaguje až na TiO2.
Sloučeniny
Oxid titaničitý
Nejdůležitější sloučeninou je oxid titaničitý, TiO2, který existuje ve třech modifikacích. První je anatas, čteverečný minerál. Brookit krystaluje jako kosočtverečný minerál a nejdůležitější modifikací je čtverečný rutil, který je využíván jako zdroj titanu a také jako součást tavidel pro svařování.

Vyrábí se dvěma způsoby:
1. Síranovým způsobem, ten byl využíván především v minulosti, dnes se od něj pomalu upouští. Surovinou je ilmenit, FeTiO3, který se reakcí s kyselinou sírovou převede na směs síranů – železnatého, železitého a titanylu (TiOSO4). Ten se po separaci ze směsi hydrolyzuje vodou a vzniklý hydrát oxidu titaničitého se kalcinuje na čistý TiO2. Kyselina sírová vzniklá po hydrolýze se neutralizuje vápencem. Oxid titaničitý vzniká jako anatas, ale lze získat i rutil, přídavkem krystalizačních jader v poslední fází výroby.
TiOSO4 + H2O → TiO2.nH2O + H2SO4
TiO2.nH2O → TiO2 + n H2O
2. Chloridový způsob, zde je výchozí surovinou přírodní rutil, který se nejprve nechá reagovat s chlorem a uhlím při teplotě 1200 °C za vzniku TiCl4. Ten se spaluje v kyslíku při 1500 °C na TiO2. V druhém kroku se uvolňuje chlor, který se vrací zpět do prvního kroku.
TiO2 + 2 Cl2 + C → TiCl4 + CO2
TiCl4 + O2 → TiO2 + 2 Cl2
Vytváří sloučeniny v oxidačních stavech II, III a IV a výjimečně i v oxidačním stavu 0. Stabilnější jsou titaničité sloučeniny. V organické chemii jsou důležité organotitaničité sloučeniny, které se využívají např. jako katalyzátory v Ziegler-Nattových reakcí.
Oxid titaničitý je sloučeninou titanu s největším průmyslovým významem. Zhruba polovina se používá jako pigment – titanová běloba. Je to také polovodič a fotokatalyzátor, využívá se i v kosmetice, např. v opalovacích krémech.
Výhoda oxidu titaničitého jako pigmentu spočívá v jeho vysokém indexu lomu, viz srovnání s jinými pigmenty:
| Pigment | Index lomu |
| CaCO3 | 1,53–1,68 |
| BaSO4 | 1,64 |
| ZnO | 2,0 |
| TiO2 (anatas) | 2,49–2,55 |
| TiO2 (rutil) | 2,61–2,90 |
Speciální aplikace
Pro speciální účely se oxid titaničitý připravuje sol-gelovým procesem, např. hydrolýzou:
Ti(OEt)4 + 2 H2O → TiO2 + 4 EtOH
Pokud potřebujeme získat tenký film, je možné využít CVD proces:
Ti(OEt)4 → TiO2 + 2 Et2O
Halogenidy
| Oxidační stav | Fluoridy | Chloridy | Bromidy | Jodidy |
| IV | TiF4 Bílý Tt=284 °C | TiCl4 bezbarvý Tt=-24 °C Tv=136,6 °C | TiBr4 oranžový Tt=39 °C Tv=230 °C | TiI4 tmavě hnědý Tt=150 °C Tv=377 °C |
| III | TiF3 Fialový Tt=1200 °C Tv=1400 °C | TiCl3 červenofialový Tt=440 °C (rozkl.) | TiBr3 modročerný Tt=550 °C | TiI3 červenofialový Tt=350 °C (rozkl.) |
| II | TiCl2 černý Tt=1035 °C Tv=1500 °C | TiBr2 černý Tt=500 °C | TiI2 černý Tt=480 °C |
Sendvičové komplexy
Známe řadu titanocenů, které jsou analogické ferrocenu, např. dichlorid titanocenu, viz obr. dole. Ten lze připravit reakcí chloridu titaničitého s cyklopentadienem nebo s cyklopentadienidem sodným.
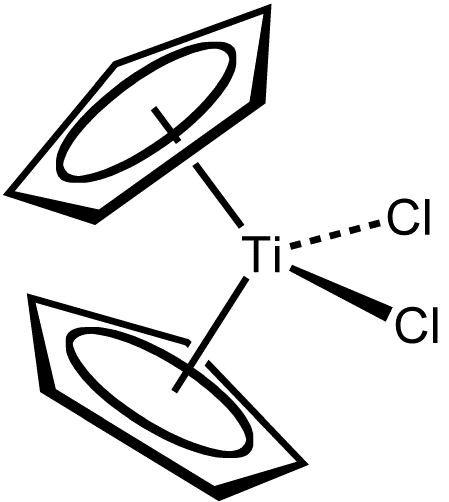
Titan byl prvním kovem, u kterého se povedla příprava sendvičového komplexu s čistě anorganickými ligandy.[5] Reakcí chloridu titaničitého s bílým fosforem se povedlo připravit a izolovat sendvičový aniontový komplex, kde je titan obklopen obklopen dvěma cyklickými anionty P5–. Průměrná délka vazby P-P je 2,154(9) Å, což ji řadí mezi jednoduchou a dvojnou P-P vazbu. Tato sloučenina se jeví jako první dostupný zdroj aniontu P5– pro další reakce.
![Anion [Ti(P5)2]2-](http://z-moravec.net/wp-content/uploads/2014/04/Ti_P5_2.png)
Karbid titanu
Karbid titanu, TiC, je extrémně tvrdý materiál, podle Mohsovy stupnice je jeho tvrdost v rozmezí 9,0-9,5 (pro srovnání diamant má tvrdost 10). Jeho krystalová struktura je podobná chloridu sodnému, krystaluje v kubické, plošně centrované krystaly. V přírodě se vyskytuje jako minerál khamrabaevit.[6]

Hlavní využití karbidu titanu je při výrobě kompozitních keramik pro řezné nástroje. Ty se označují jako CerMet – Ceramic Metal. Vysoké tepelné odolnosti se také využívá v tepelných štítech raketoplánů a raket.
NMR
Titan má dva NMR aktivní izotopy. Oba mají nízkou citlivost, zajímavostí je velmi malý rozdíl rezonančních frekvencí obou jader, proto je při měření pozorujeme obě naráz. Sloučeniny titaničité poskytují poměrně úzké signály, titanité sloučeniny jsou paramagnetické a proto není možné jejich měření. Standardem je většinou TiCl4.
| 47Ti | 49Ti | |
|---|---|---|
| Jaderný spin | 5/2 | 7/2 |
| Přírodní zastoupení [%] | 7,44 | 5,41 |
| Rezonanční frekvence při B=1 T | 2,4041 | 2,4045 |
| Citlivost vůči 1H | 0,000156 | 0,000205 |
| Citlivost vůči 13C | 0,918 | 1,2 |
| Rozsah chemických posunů | -1400 – +1400 ppm | |
| Jaderný magnetický moment | -0,78848 | -1,10417 |
Chemické posuny
| Roztok TiI4 | 1400-1200 | Methyltrihalogenidy | 800-600 |
|---|---|---|---|
| TiBr4 | 480 | TiCl4 | 0 |
| Roztok TiCl4 | 0-(-300) | N-komplexy | (-150)-(-350) |
| Cyklopentadienyl trihalogenidy | -50-(-450) | Cyklopentadienyl dihalogenidy | -400-(-900) |
| O-komplexy | -800-(-950) | TiF62- | -1150-(-1300) |
| Ti(CO)62- | -1300-(-1450) |
Odkazy
- Titan na české wikipedii
- Titan na anglické wikipedii
- Titanium NMR
- 47Ti a 49Ti NMR reference
- Urnius, E., Brennessel, W. W., Cramer, C. J., Ellis, J. E. & Schleyer, P. von R. A carbon-free sandwich complex [(P5)2Ti]2-. Science 295, 832–4 (2002). DOI: 10.1126/science.1067325.
- Khamrabaevite
- Ilmenit
- Rutil
- Isotopes of titanium
- Nucleosynthesis in the Universe, Understanding 44Ti
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
16 Replies to “Titan”