Elektrochemie je obor chemie, který zkoumá procesy probíhající na rozhraní elektrod (kovových nebo polokovových, příp. grafitových) a elektrolytu. Základy elektrochemie byly položeny v období 16.–18. století, kdy začali vědci experimentovat s elektřinou a magnetismem.
Základní pojmy
- Elektrolyt — látka, která je schopná se štěpit na ionty, v roztoku nebo tavenině, např. NaCl, CuSO4.
- Elektrolýza — technika využívající stejnosměrný proud jako zdroj energie pro chemickou reakci.
- Elektroda — elektrický vodič, který je v kontaktu s nekovovou částí obvodu, tj. vakuem, polovodičem, elektrolytem nebo vzduchem.
- Anoda — elektroda, na které probíhá oxidace
- Katoda — elektroda, na které probíhá redukce
- Elektroda 1. druhu — kov, ponořený do roztoku své vlastní soli, např. stříbrný drát ponořený do roztoku stříbrné soli.
- Elektroda 2. druhu — kov, pokrytý jeho nerozpustnou solí a ponořený do roztoku, který obsahuje stejný anion jako nerozpustná sůl, např. argentochloridová elektroda. Ta je tvořena stříbrným drátem, potaženým chloridem stříbrným (AgCl) a ponořeným do roztoku KCl.
Elektrolyty
Jako elektrolyty označujeme roztoky nebo taveniny, které vedou elektrický proud. Nejčastěji vznikají rozpouštěním iontových látek v polárních rozpouštědlech (nejčastěji ve vodě).
Pravé elektrolyty jsou iontové i v pevném stavu, např. NaCl.
Potencionální elektrolyty obsahují kovalentní vazby, ionty vznikají až při rozpouštění v polárních rozpouštědlech. Jde např. o HCl nebo H2SO4.
Podle stupně disociace rozlišujeme slabé a silné elektrolyty. Silné elektrolyty, např. NaCl, disociují zcela, naproti tomu slabé elektrolyty, např. HClO jsou disociované pouze z části.
NaCl → Na+ + Cl–
HClO ⇄ H+ + ClO–
Elektrolýza
Elektrolýza je proces, využívající stejnosměrný elektrický proud jako zdroj energie pro chemické reakce. Jde o velmi důležitý proces využívaný v mnoha průmyslových odvětvích. Elektrolýza probíhá v roztocích nebo taveninách, klasickým příkladem je elektrolytický rozklad vody na vodík a kyslík, tento proces se může stát základem vodíkového hospodářství:
2 H2O → 2 H2 + O2
Kvantitativní stránka elektrolytických procesů je popsána pomocí Faradayových zákonů, které publikoval Michael Faraday roku 1834.[1]
1. Faradayův zákon
Hmotnost vyloučené látky je úměrná proudu (I), který prochází elektrolytem a času (t), po který elektrolýza probíhala. Neboli je hmotnost vyloučené látky úměrná elektrickému náboji (Q = I.t), který prošel elektrolytem.
m = A.I.t = A.Q
A je chemický ekvivalent, který je definován 2. Faradayovým zákonem.
2. Faradayův zákon
Látková množství vyloučená jednotkovým nábojem jsou pro všechny látky ekvivalentní.
$$\textrm{A}\ =\ \frac{\textrm{M}}{\textrm{F.z}}\ \ [\textrm{kg.C}^{-1}]$$
M je molární hmotnost vyloučené látky, z je počet vyměňovaných elektronů a F je Faradayova konstanta, což je náboj jednoho molu elektronů.
F = e.NA = 1,602176565.10-19×6,02214129.1023 = 96 485,33 C.mol-1
Příklad výpočtu
Kolik hořčíku získáme elektrolýzou taveniny MgCl2? Elektrolýzu provádíme proudem 1,7 A po dobu 2,5 hodiny.
Při elektrolýze dochází k redukci hořečnatých iontů podle rovnice:
Mg2+ + 2 e– → Mg
Z rovnice vyplývá, že k redukci jsou potřeba dva elektrony, proto elektrochemický ekvivalent vypočítáme:
$$\textrm{A}\ =\ \frac{\textrm{M}}{\textrm{F.z}}\ =\ \frac{24,3}{96485 . 2}\ =\ 0,00013\ \textrm{g.C}^{-1}$$
Hmotnost vyloučeného hořčíku spočítáme z rovnice (2,5 hodiny musíme převést na 9000 s):
$$\textrm{m}\ =\ \textrm{A.I.t}\ =\ 0,00013\ .\ 1,7\ .\ 9000\ =\ 1,99\ \textrm{g Mg}$$
Elektrolýzou získáme 1,99 g hořčíku.
Další příklady na téma elektrolýza jsou zde.
Elektrodový potenciál
Elektrodový potenciál (E) – potenciál elektrody vůči standardní vodíkové elektrodě, jednotkou je volt [V]. Počítá se pomocí Nernst-Petersonovy rovnice.
Standardní elektrodový potenciál (E0) – elektrodový potenciál za standardních podmínek.
$$\textrm{E}\ =\ \textrm{E}^0\ -\ \frac{\textrm{R.T}}{\textrm{z.F}}\ln\ \textrm{c}$$
R – molární plynová konstanta (8,314 J.K-1.mol-1)
T – teplota [K]
c – molární koncentrace iontu
$$\textrm{E}\ =\ \textrm{E}^0\ -\ \frac{\textrm{R.T}}{\textrm{z.F}}\ln\ \frac{\textrm{a}_{\textrm{red}}}{\textrm{a}_{\textrm{ox}}}$$
ared – aktivita redukované formy
aox – aktivita oxidované formy
Standardní vodíková elektroda
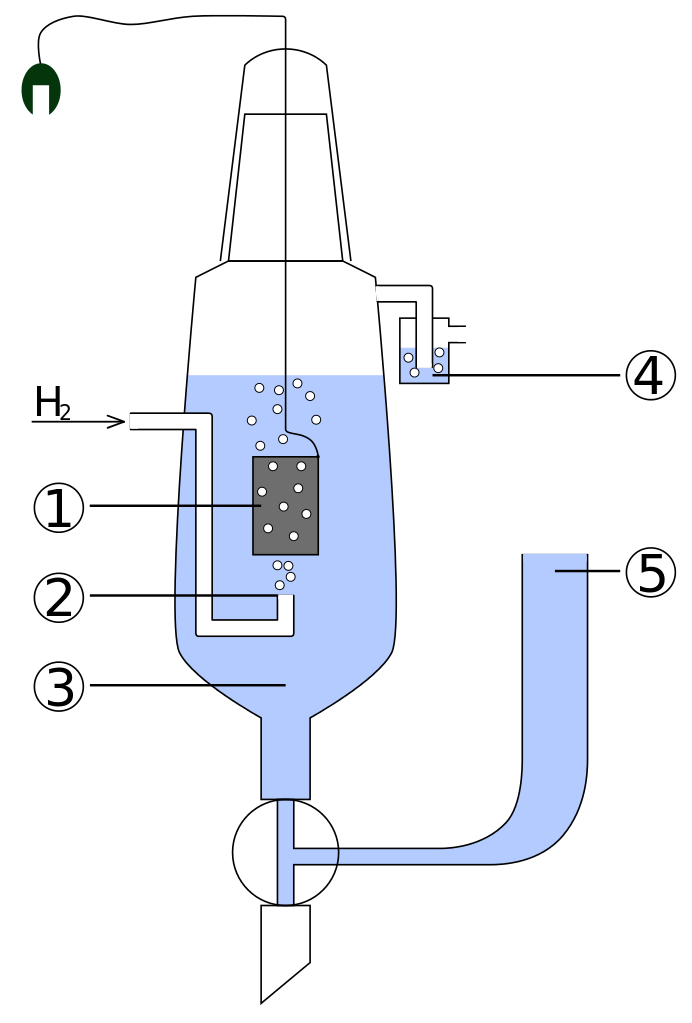
Standardní vodíková elektroda (SVE) – platinový drátek pokrytý platinovou černí(1), sycený plynným vodíkem(2) pod tlakem 101 325 Pa za teploty 273,15 K, ponořený do roztoku o jednotkové aktivitě H+(3). Je to univerzální referenční elektroda pro protické rozpouštědla. Standardní elektrodový poteciál (H+/H2) je nulový za všech teplot.[2]
Standardní elektrodové potenciály
| Elektroda | E0 [V] | Elektroda | E0 [V] |
|---|---|---|---|
| Li/Li+ | −3,045 | Cu/Cu2+ | +0,337 |
| Cs/Cs+ | −2,923 | Cu/Cu+ | +0,521 |
| Mg/Mg2+ | −2,363 | Ag/Ag+ | +0,799 |
| Zn/Zn2+ | −0,762 | Pt/Pt2+ | +1,200 |
| Fe/Fe2+ | −0,440 | Au/Au3+ | +1,498 |
| Ni/Ni2+ | −0,250 | Mn3+/Mn2+ | +1,51 |
| H+/H2 | 0,000 | Ce4+/Ce3+ | +1,61 |
Beketovova řada kovů obsahuje kovy seřazené podle standardních elektrodových potenciálů.
Literatura
- Faraday’s electrochemical laws and the determination of equivalent weights
- IUPAC Gold Book – Standard hydrogen electrode
- Elektrochemie pro chemiky aneb Základy molekulární elektrochemie – kniha z VŠCHT
Další kapitoly
- České chemické názvosloví
- Platné číslice a měření
- Základní chemické zákony
- Důležité veličiny a vztahy v chemii
- Výpočet stechiometrického vzorce
- Chemické rovnice a stechiometrické výpočty
- Koncentrace roztoků
- Rozpustnost, součin rozpustnosti
- Stavba atomu
- Periodická tabulka prvků a periodicita vlastností
- Chemická vazba
- VSEPR
- Komplexní sloučeniny
- Magnetické vlastnosti látek
- Termodynamika
- Chemická rovnováha
- Skupenské stavy látek
- Fázové rovnováhy
- Teorie kyselin a zásad
- pH, aktivita roztoku
- Elektrochemie
- Symetrie molekul
- Laboratorní technika
- Lineární regrese
- Jednotky tlaku
- Jednotky teploty
- Mohsova stupnice tvrdosti minerálů
- Odkazy
- Prezentace k semináři z obecné chemie
3 Replies to “Elektrochemie”