Koncentrace je veličina popisující složení směsí. Možností jak vyjádřit koncentrace je hodně, tady se věnuji jen těm nejběžnějším.
Sbírku řešených příkladů na téma koncentrace najdete zde.
Molární koncentrace
Tato koncentrace se velmi často využívá v analytické chemii, jde o poměr látkového množství a objemu celého roztoku. Jednotkou je mol.dm-3, často se zapisuje zkráceně jako M.
$$\textrm{c} = \frac{\textrm{n}}{\textrm{V}} = \frac{\textrm{m}}{\textrm{MV}}$$
Roztoky o přesné molární koncentraci se připravují do odměrných baněk, což jsou nádoby s velmi přesně kalibrovaným objemem (kalibrace na dolití – IN). Látka se nejprve kvantitativně rozpustí v cca 2/3 objemu a potom se odměrná baňka doplní po rysku. S odměrnými baňkami je nutno zacházet jako s přesně kalibrovaným sklem, tzn. že je nelze sušit v sušárnách, aby nedošlo ke změně jejich objemu.
Molální koncentrace
Poměr látkového množství rozpuštěné látky a hmotnosti rozpouštědla (ms). Jednotkou je mol.kg-1. Někdy se můžeme potkat i s objemovou molalitou, kde je hmotnost rozpouštědla nahrazena jeho objemem.
$$\mu = \frac{\textrm{n}}{\textrm{m}_\textrm{s}}$$
Molární zlomek
Podíl látkového množství složky a součtu látkových množství všech složek ve směsi. Součet molárních zlomků všech složek směsi je roven 1 (100 %). Často se využívá u plynů.
$$\textrm{X}_1 = \frac{\textrm{n}_1}{\sum\limits_{\textrm{i}=1}^\textrm{n} \textrm{n}_\textrm{i}} = \frac{\textrm{n}_1}{\textrm{n}_1 + \textrm{n}_2 + \ldots + \textrm{n}_\textrm{n}}$$
Hmotnostní zlomek
Podíl hmotnosti složky a celkové hmotnosti směsi. Součet hmotnostních zlomků všech složek směsi je roven 1 (100 %).
$$\textrm{w}_1 = \frac{\textrm{m}_1}{\sum\limits_{\textrm{i}=1}^\textrm{n} \textrm{m}_\textrm{i}} = \frac{\textrm{m}_1}{\textrm{m}_1 + \textrm{m}_2 + \ldots + \textrm{m}_\textrm{n}}$$
Směšovací rovnice
V laboratoři často potřebujeme upravovat koncentraci roztoků, nejčastěji zředit. Např. připravit z koncentrované kyseliny sírové (96 %) 1 kg roztoku o koncentraci 20 %. Potřebný výpočet snadno provedeme pomocí směšovací rovnice:
m1w1 + m2w2 = mw
kde jsou na levé straně rovnice výchozí roztoky (w je pro vodu rovno 0, pro čistou látku 1) a na pravé straně připravovaný roztok. Pro náš příklad by to bylo:
m1 * 0,96 + m2 * 0 = 1 * 0,20
m1 = 0,21 kg
m2 = 0,79 kg
Takže potřebujeme 210 g koncentrované kyseliny a 790 g vody.
Lze použít i tzv. křížové pravidlo. Na levou stranu kříže dáme koncentrace výchozích roztoků, doprostřed požadovanou koncentraci a po odečtení čísel na diagonálách získáme hmotnostní díly potřebné pro přípravu roztoku.
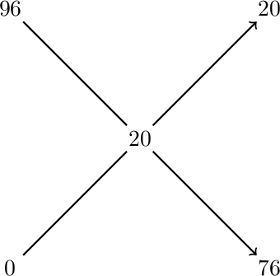
Součet hmotnostních dílů na pravé straně je 96, tzn. že hmotnost roztoku (1 kg) musíme rozdělit na 96 dílů – 1 díl bude vážit 0,0104 kg. Potom jednoduše zjistíme, že potřebujeme 20×0,0104 = 0,21 kg kyseliny a 0,79 kg vody, což odpovídá výpočtu podle směšovací rovnice.
Rozpouštění hydrátů
Pokud rozpouštíme hydráty solí ve vodě, musíme při výpočtu pracovat s hmotností samotné soli. Jako ukázku můžeme použít modrou skalici, CuSO4.5H2O.
Zadání: Jakou koncentraci má roztok připravený rozpuštěním 30 g modré skalice ve 100 g vody?
Řešení
Modrá skalice je pentahydrát síranu měďnatého, CuSO4.5H2O. Koncentraci vypočítáme podle vztahu:
$$\textrm{w} = \frac{\textrm{m}_{\textrm{CuSO}_4}}{\textrm{m}_{\textrm{celk}}}$$
Hmotnost roztoku (mcelk) je rovna součtu hmotnosti vody a modré skalice, tzn. 130 g.
Složitější je výpočet hmotnosti síranu měďnatého. Potřebujeme k tomu molární hmotnosti síranu měďnatého i modré skalice:
| Látka | Molární hmotnost [g.mol-1] |
| CuSO4.5H2O | 249,68 |
| CuSO4 | 159,61 |
Hmotnost síranu měďnatého vypočítáme vynásobením poměru molárních hmotností a hmotnosti modré skalice:
$$\textrm{m}_{\textrm{CuSO}_4} = \frac{159,61}{249,68} . 30 = 19,18\textrm{ g}$$
a koncentraci pak vypočítáme dosazením do vztahu:
$$\textrm{w} = \frac{\textrm{m}_{\textrm{CuSO}_4}}{\textrm{m}_{\textrm{celk}}} = \frac{19,18}{130} = 0,1475$$
Odpověď: Získáme roztok o koncentraci 14,75 % CuSO4.
Další kapitoly
- České chemické názvosloví
- Platné číslice a měření
- Základní chemické zákony
- Důležité veličiny a vztahy v chemii
- Výpočet stechiometrického vzorce
- Chemické rovnice a stechiometrické výpočty
- Koncentrace roztoků
- Rozpustnost, součin rozpustnosti
- Stavba atomu
- Periodická tabulka prvků a periodicita vlastností
- Chemická vazba
- VSEPR
- Komplexní sloučeniny
- Magnetické vlastnosti látek
- Termodynamika
- Chemická rovnováha
- Skupenské stavy látek
- Fázové rovnováhy
- Teorie kyselin a zásad
- pH, aktivita roztoku
- Elektrochemie
- Symetrie molekul
- Laboratorní technika
- Lineární regrese
- Jednotky tlaku
- Jednotky teploty
- Mohsova stupnice tvrdosti minerálů
- Odkazy
- Prezentace k semináři z obecné chemie

2 Replies to “Koncentrace roztoků”