Voda (H2O) je velice zajímavá molekula, a i když ji už studujeme opravdu dlouhou dobu, tak se stále dají najít nové informace.
Molekula vody je malá, skládá se jen z tří atomů. Díky velkému rozdílu elektronegativit mezi kyslíkem a vodíkem je voda i velmi polární molekulou. V souladu s teorií VSEPR je její molekula lomená s úhlem HOH zhruba 105°.
Ve vodě se nepotkáváme jen s molekulami H2O, ale samozřejmě jsou zde i ionty H3O+ a OH–, jejich existence je svázána s pojmem pH. Za exotičtějších podmínek se ale můžeme potkat se složitějšími částicemi. Pokud vodu ionizujeme získáme kation H2O+, který může vytvářet dimerní struktury (H2O)2+.
Tento dimerní kation může existovat ve dvou formách, u první je interakci mezi vodami zprostředkována protonem (H3O+· OH–,proton-transfer) a u druhé je o sdílen nepárový elektronu oběma molekulami (hemi-bonded). Nepárový elektron vzniká vyražením elektronu z jednoho nevazebného elektronového páru na kyslíku vody.
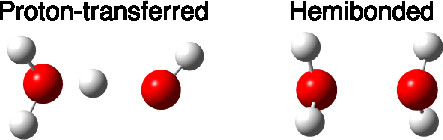
Dimery byly připraveny za velmi nízké teploty (0,4 K) pomocí nanokapek supratekutého helia. Helium bylo vedeno přes komoru s vodní parou a přes skimmer byly nanokapky zavedeny do komory, kde došlo k ionizaci nárazem elektronu (electron-impact) a poté byly zavedeny do kvadrupalárního analýzátoru hmotnostního spektrometru. Hmotnostní spektrometr umožnil selekci iontů o m/z 36 (poměr hmotnosti a náboje iontu), což odpovídá hledanému dimeru. Analýza pak byla provedena pomocí infračervené spektroskopie. Tady se, mimo jiné, ukázal zajímavý pás okolo 2000 cm-1, který patří sdílenému protonu v charge-transfer dimeru.
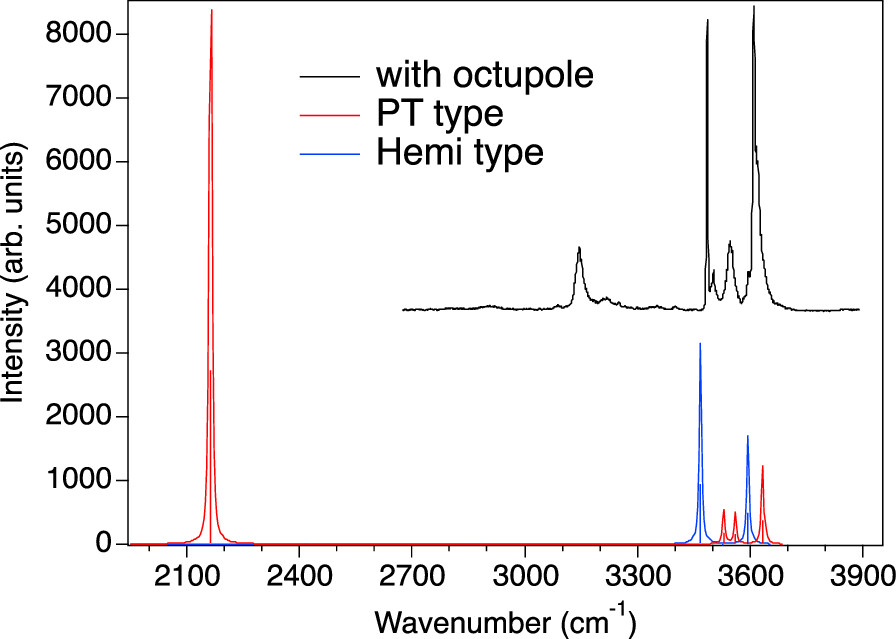
Studie prokázala existenci obou typů dimerů a byla provedena i jejich charakterizace pomocí infračervené spektroskopie.