Bor, B, je nejlehčí prvek ze skupiny trielů. Vyskytuje se v krystalické a amorfní modifikaci. Využívá se ve sklářství, a díky vysokému účinnému průřezu izotopu 10B i v jaderné energetice, jako součást řídících tyčí.
| Atomové číslo | 5 | Počet stabilních izotopů | 2 |
| Atomová hmotnost | 10,811 | Elektronová konfigurace | [He] 2s2 2p1 |
| Teplota tání [°C] | 2076 | Teplota varu [°C] | 3927 |
| Elektronegativita | 2,04 | Hustota [g.cm-3] | 2,08 |
Izotopy
Přírodní bor je směsí dvou izotopů, oba jsou NMR aktivní, ale mají spin větší než ½. Známe 13 radioizotopů, všechny mají velmi krátké poločasy přeměny (kratší než 0,8 s), proto nemají praktické využití.
| Izotop | Zastoupení v přírodě [%] |
| 10B | 19,65 |
| 11B | 80,35 |
Chemické vlastnosti
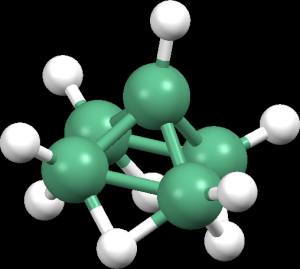
Elementární bor je v modifikaci α tvořen ikosaedry B12, vazebné elektrony v celém ikosaedru jsou delokalizovány. Modifikace β je tvořena klastry B84, které jsou pospojovány jednotkami B10.
Hlavními minerály boru jsou borax Na2[B4O5(OH)4]∙8H2O a kernit Na2[B4O5(OH)4]∙2H2O. Výroba boru je poměrně náročný proces, vychází se z boraxu, který se převádí na oxid boritý.
Na2[B4O5(OH)4]∙8H2O + H2SO4 → 4 H3BO3 + Na2SO4 + 5 H2O
2 H3BO3 → B2O3 + 3 H2O
Pokud není potřeba čistý bor, redukuje se oxid hořčíkem a produkt se promývá alkalickým roztokem a poté kyselinou chlorovodíkovou a fluorovodíkovou. Čistý bor se připravuje termickým rozkladem B2H6 nebo BI3, příp. redukcí BBr3 vodíkem.
Borová vlákna se vyrábějí pomocí CVD, kdy se BCl3 a vodík vedou přes elektricky žhavený wolframový drát, na kterém dochází k redukci a vzniká bor.
2 BCl3 + 3 H2 → 2 B + 6 HCl
Za normálních podmínek je bor poměrně inertní, reaguje pouze s elementárním fluorem. Za vyšších teplot reaguje s většinou nekovů i kovů.
V roce 2025 byla připravena první sloučenina s trojnou vazbou mezi uhlíkem a borem.
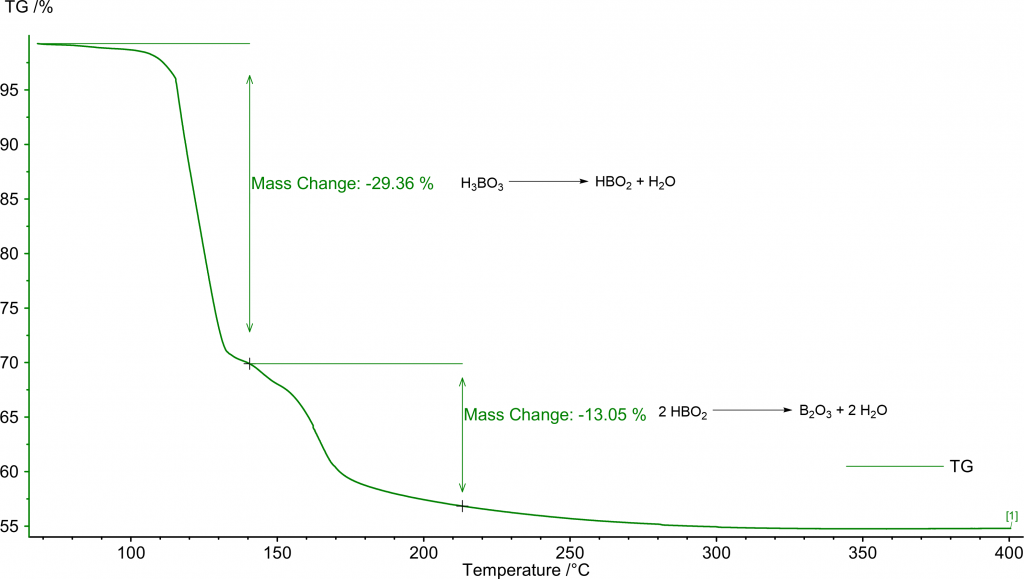
Oxidy
Nejběžnějším oxidem boru je oxid boritý, B2O3. Ale známe i monooxid boru, BO, ten byl poprvé připraven v roce 1940 termickým rozkladem tetrahydroxydiboranu, B2(OH)4, při teplotách 200-500 °C.
B2(OH)4 → 2 BO + 2 H2O
Jeho struktura byla objasněna až po více než 80 letech za využití NMR spektroskopie.
Můžeme ho snadno připravit termickou dehydratací kyseliny borité:
2 H3BO3 → B2O3+ 3 H2O
Průběh dehydratace lze pěkně sledovat pomocí termické analýzy:
Borany
Borany jsou důležitou a také velmi zajímavou skupinou sloučenin boru. První byly připraveny již roku 1912 německým chemikem Alfredem Stockem. Kromě zajímavé struktury získaly tyto sloučeniny pozornost i díky vysoké energii, kterou v sobě skrývají. Z toho důvodu byly v průběhu studené války zkoumány jako potenciální raketové palivo, i když nakonec nebyly tyto plány převedeny do praxe. V roce 1948 byla pomocí RTG strukturní analýzy objasněna struktura dekaboranu a o rok později byla poprvé popsána třístředová dvouelektronová vazba v B-H-B.
Základním boranem je diboran B2H6, bezbarvý, velmi reaktivní plyn. Vyšší borany jsou pojmenovány pomocí počtu borových atomů a do závorky se uvádí počet vodíků, např. pentaboran(9) B5H9.
V boranech se setkáváme s dvouelektronovou, třícenterní vazbou v uspořádáních B-H-B a B-B-B.
Borany tvoří klastry, jejich struktury rozlišujeme podle uzavřenosti (otevřenosti) klastru:
- Hypercloso – kompletně uzavřené klasty, např. B8H8.
- Closo – uzavřené klastry, např. B12H122-.
- Nido – bor obsazuje n vrcholů n+1 vrcholového klastru, např. B5H9.
- Arachno – bor obsazuje n vrcholů n+2 vrcholového klastru, např. B4H10.
- Hypho – bor obsazuje n vrcholů n+3 vrcholového klastru, např. B8H16.
- Conjucto – dva a více spojených klastrů dohromady, např. B21H18–.
Diboran
Jeden z nejprostudovanějších boranů, B2H6. Slouží jako výchozí látka pro přípravu vyšších boranů.
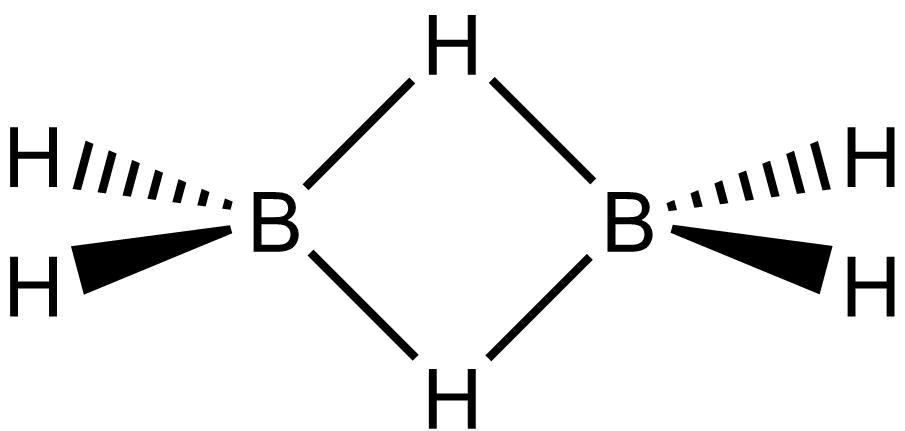
Laboratorně ho lze připravit z tetrahydridoboritan sodného, ve větších množstvích se vyrábí z fluoridu boritého.
- 2 NaBH4 + I2 → B2H6 + 2 NaI + H2
- 2 NaBH4 + 2 H2PO4 → B2H6 + 2 NaH2PO4 + H2
- 2 BF3 + 6 NaH → B2H6 + 6 NaF
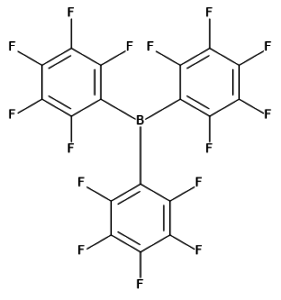
Tris(pentafluorofenyl)boran
Velice zajímavou sloučeninou ze skupiny boranů je tris(pentafluorofenyl)boran, B(C6F5)3. Jde o bílou, krystalickou látku a velmi silnou Lewisovu kyselinu. Z hlediska Lewisovské kyselosti je silnější než BF3, ale slabší než BCl3.
Využívá se v katalýze, protože dokáže abstrahovat hydridový anion (H–) za tvorby iontu [HB(C6F5)3]–, takže funguje jako aktivátor katalyzátoru nebo jako kokatalyzátor. Je také důležitou sloučeninou pro studium tzv. frustrovaných Lewisových párů, což jsou sloučeniny, které obsahují stericky (prostorově) náročnou Lewisovu kyselinu i bázi a díky prostorové náročnosti nemohou vytvořit klasický adukt. Tyto systémy by mohly být zajímavé např. pro hydrogenační reakce:[8, 9]
PCy3 + B(C6F5)3 + H2 → [HPCy3]+[HB(C6F5)3]−
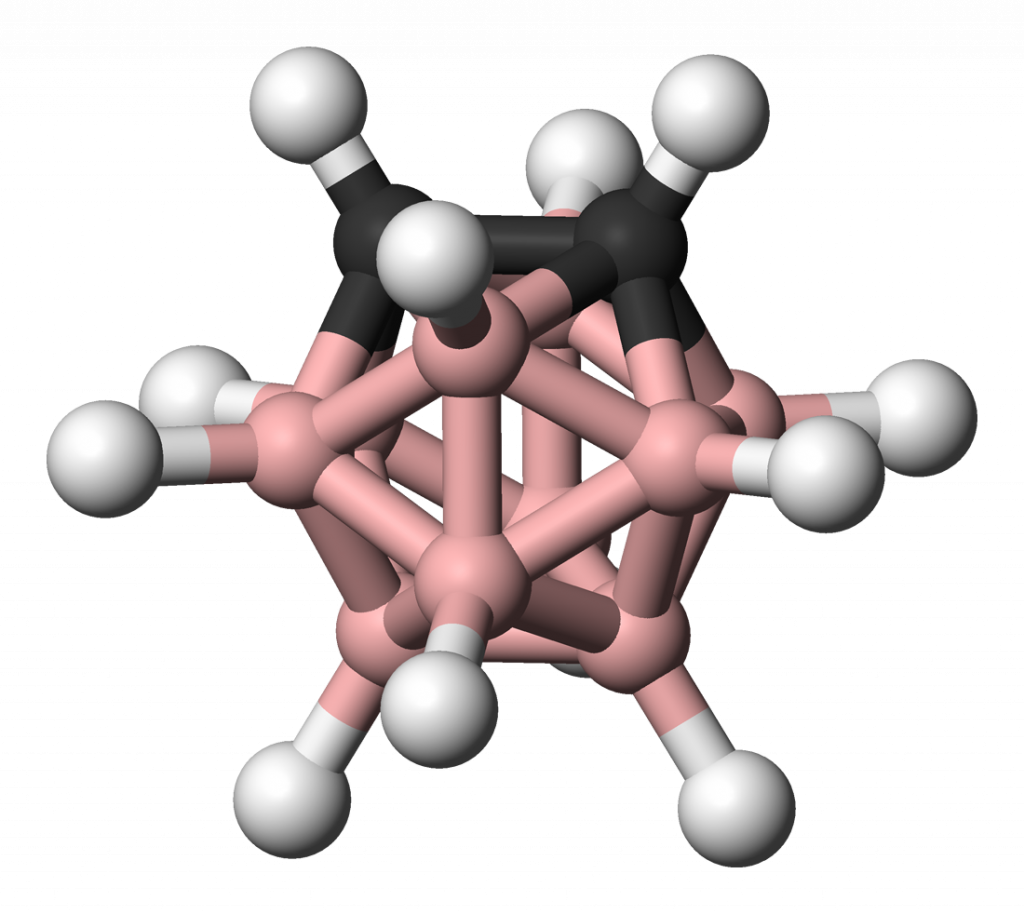
Karborany
Pokud jeden nebo více atomů boru v boranové struktuře nahradíme uhlíkem, získáme tzv. karborany. Byly objeveny už v roce 1962 a jejich výzkum se rychle rozvíjel jak v USA, tak v bývalém SSSR. Asi nejrozšířenějším typem jsou closo-karborany, které se připravují pyrolýzou boranů s acetylenem. Jde o těkavé kapaliny, příp. u těžších molekul, o pevné látky.
Halogenidy
Trihalogenidy boru jsou těkavé a velmi reaktivní. Nemají sklon k dimeraci, existují ve monomerní formě. Jsou, v souladu s teorií VSEPR, trigonálně planární se symetrií D3h.
| BF3 | BCl3 | BBr3 | BI3 | |
| Teplota varu [°C] | −99,9 | 12,5 | 91,3 | 210 |
| Teplota tání [°C] | −127,1 | −107 | −46 | 49,9 |
Fluorid boritý, BF3, se využívá jako katalyzátor v mnoha procesech. Vyrábí se reakcí boritanů s fluoridem vápenatým nebo s kyselinou fluorovodíkovou:
6 CaF2 + Na2B4O7 + 8 H2SO4 → 2 NaHSO4 + 6 CaSO4 + 7 H2O + 4 BF3
Na2B4O7 + 12 HF → [Na2O(BF3)4] + 6 H2O
[Na2O(BF3)4] + 2 H2SO4 → 2 NaHSO4 + H2O + 4 BF3
Borazin
Borazin, B3N3H6, je cyklická molekula izoelektronová s benzenem. Je to bezbarvá kapalina s aromatickým zápachem.

Připravuje se reakcí síranu amonného s tetrahydridoboritanem sodným:[13]
6 NaBH4 + 3 (NH4)2SO4 → 2 B3N3H6 + 3 Na2SO4 + 18 H2
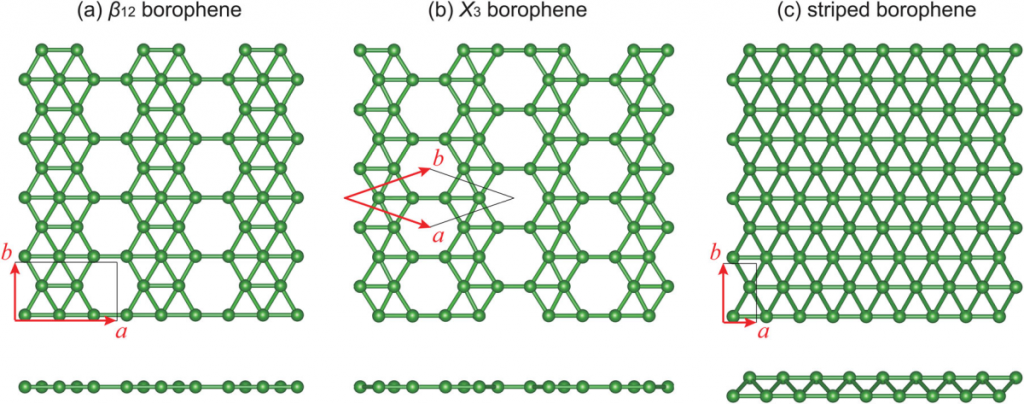
Borofen
Borofen je monomolekulární vrstva boru (2D modifikace).[11] Skládá se z trojúhelníků, to je způsobeno třemi elektrony ve valenční slupce bóru. Poprvé byl připraven roku 2015 depozicí bóru na stříbrný substrát.[12] Příprava byla inspirována syntézou silicenu (2D modifikace křemíku).
Jako lepší metoda se na základě výpočtů jeví depozice boru na povrch hexagonálního nitridu boritého.
Boridy
Boridy jsou sloučeniny boru s elektropozitivnějšími kovy. Je jich známo už poměrně velké množství a jejich vlastnosti jsou velmi zajímavé pro průmyslové aplikace, jsou zpravidla žáruvzdorné.
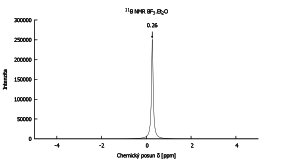
NMR
Standardem pro borové NMR je etherát fluoridu boritého BF3.Et2O. Existence dvou izotopů vede ke tvorbě izotopomerů, což se projevuje v NMR spektrech, např. u BF4−.
10B NMR
Signály 10B NMR jsou širší než u 11B a toto jádro má i nižší citlivost. Proto se častěji měří 11B NMR.
| Spin | 3 |
|---|---|
| Zastoupení v přírodě | 19,9 % |
| Jaderný magnetický moment | +1,800645 |
| Rozsah chemických posunů | -120 až 90 ppm |
| Relativní citlivost k 1H | 3,96×10-3 |
| Relativní citlivost k 13C | 23,2 |
11B NMR
Jádro 11B je citlivější a poskytuje užší signály.
| Spin | 3/2 |
|---|---|
| Zastoupení v přírodě | 80,1 % |
| Jaderný magnetický moment | +2,688649 |
| Rozsah chemických posunů | -120 až 90 ppm |
| Relativní citlivost k 1H | 0,165 |
| Relativní citlivost k 13C | 970 |
Odkazy
- Bor na české wikipedii
- Bor na anglické wikipedii
- Boron NMR
- Graphene-like material made of boron a possibility, experiments suggest
- Boron enters flatland: Borophene sheets on the way
- Dulmage, W.J.; Lipscomb, W.N. Acta Cryst. (1952). 5, 260-264. The crystal and molecular structure of pentaborane
- Borophene: Scientists create atomically thin boron
- Reversible, Metal-Free Hydrogen Activation
- Tris(pentafluorophenyl)borane and Beyond: Modern Advances in Borylation Chemistry
- Boron Isotope Effects in Fluorine NMR Spectra
- Borofen
- Synthesis of borophenes: Anisotropic, two-dimensional boron polymorphs
- Borazine, Polyborazylene, β-Vinylborazine, and Poly(β-Vinylborazine)
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
13 Replies to “Bor”