Dostupný a levný vodík je základem pro vodíkové hospodářství. Dnes sice umíme vyrobit vodík poměrně levně, ale neekologicky. Proto se neustále hledají udržitelnější způsoby výroby tohoto plynu.
Vodíkové hospodářství je jedna z možných cest jak snížit množství oxidu uhličitého, které lidstvo vypouští do životního prostředí.
Barvy vodíku
Vodík je samozřejmě plyn bez barvy a zápachu, ale označuje se barvami, které symbolizují vliv jeho výroby na životní prostředí. Jako černý až šedý vodík se označuje vodík vyrobený metodami, které produkují oxid uhličitý fosilních zdrojů, zelený vodík je pak vodík získávaný z vody pomocí energie z obnovitelných zdrojů.
Získávání vodíku z vody
Voda je jako zdroj vodíku ideální, k dispozici jí máme prakticky neomezené množství. Vedlejším produktem rozkladu je zpravidla kyslík. Problémem je, jak molekulu vody donutit, aby se rozložila tak, jak potřebujeme.
Elektrolýza vody
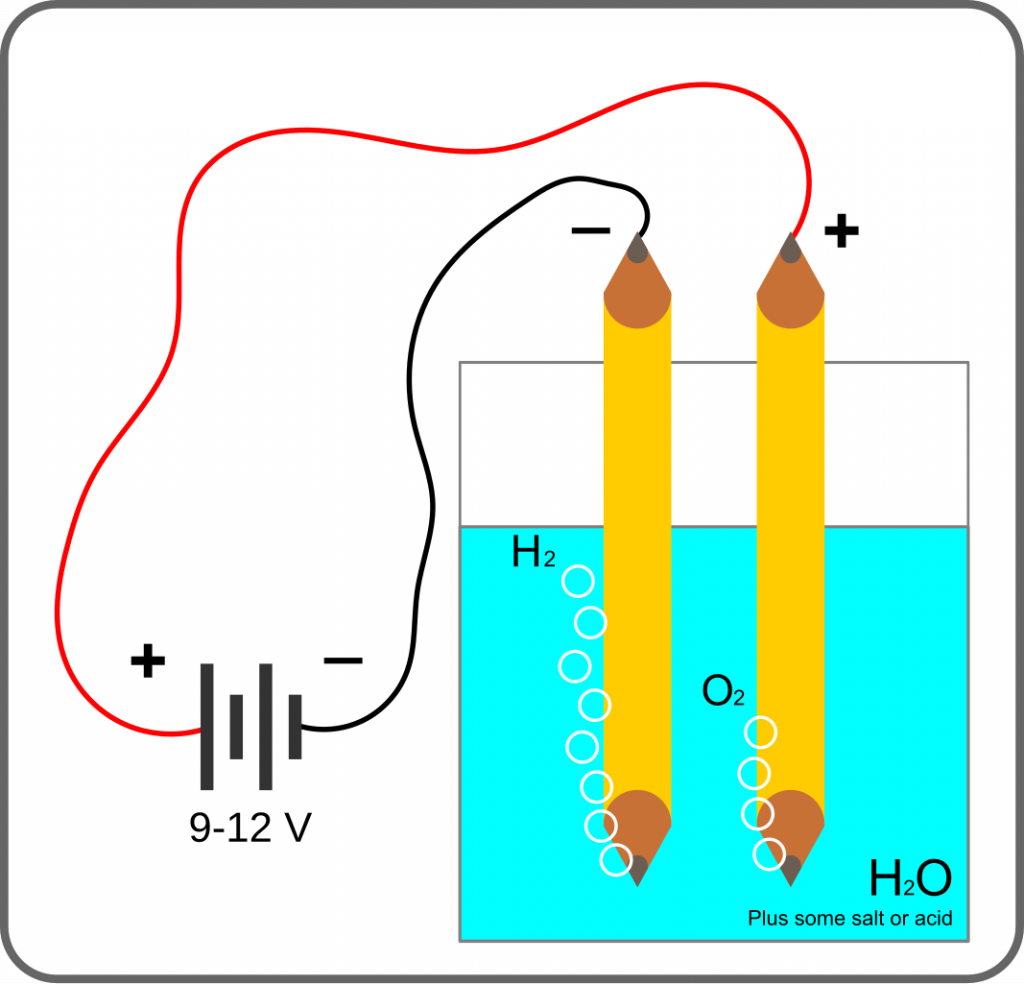
As nejběžnější metodou je elektrolýza, pomocí elektrického proudu donutíme vodu, aby se rozložila na vodík a kyslík. Z chemického pohledu dojde k redukci vodíku a oxidaci kyslíku:
2 H+ + 2 e– → H2
2 O2- → O2 + 4 e–
Celková reakce je pak:
2 H2O → 2 H2 + O2
Minimální hodnota napětí vyžadovaná pro elektrolýzu vody je 1,23 V, zpravidla se využívá 1,5 V. U vody je také problém s velice nízkou vodivostí, proto se do ní přidává zdroj iontů, v laboratorních podmínkách stačí kapka kyseliny nebo trochu soli.
Fotokatalytický rozklad vody
Další možnou cestou od vody k vodíku je fotokatalytický rozklad, tzn. rozklad pomocí vhodného katalyzátoru v přítomnosti slunečního záření. To je samozřejmě velice lákavá možnost, protože odpadá nutnost přeměny dopadajícího záření na elektřinu. Zakopaný pes je ve vhodném katalyzátoru, musí se jednat o dostupnou, levnou a stabilní látku, která zvládne katalyzovat rozklad co největšího množství vody a ideálně co nejvyšší rychlostí.
Jako velice perspektivní se (nejen) v této oblasti jeví tzv. MOFy (Metal-Organic Framework), neboli koordinační polymery skládající se z kovových klastrů propojených organickými linkery. Tyto materiály mají zpravidla velice vysoký měrný povrch, což je pro katalytické aplikace velice důležité.
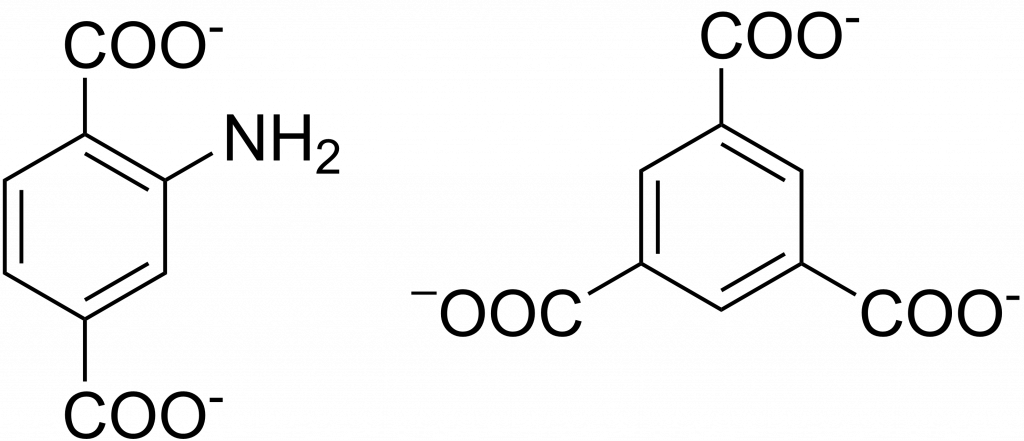
Příprava katalyzátorů pro fotokatalytický rozklad vody
Katalyzátory byly připraveny syntézou MOFů: MIL-125-NH2 a Ru-HKUST-1. MIL-125-NH2 obsahuje klastr Ti8O8(OH)4 propojený 2-aminotereftalátovými linkery[2] a Ru-HKUST-1 se skládá z jednotek Ru3 propojených 1,3,5-benzentrikarboxylátovými linkery.[3] Dále byl ještě testován MOF obsahující zinečnaté ionty.
Produkt byl následně kalcinován při teplotě 500 °C společně s thiomočovinou, (NH2)2C=S. Získané katalyzátory (RuO2/N,S-TiO2) pak byly testovány na fotokatalytický rozklad vody. Problémem tohoto systému je samozřejmě ruthenium, které patří mezi platinové kovy, tzn. jedny z nejvzácnějších prvků v zemské kůře. Nejvyšší aktivitu vykázal katalyzátor obsahující hlavně dostupný TiO2 a pouze 0,56 % RuO2.
Připravené a nedávno publikované katalyzátory jsou slibným krokem k dostupnějšímu a hlavně ekologičtějšímu vodíku.