Pomocí výpočetních metod byla předpovězena možnost existence čtverné vazby mezi atomy uhlíku a železa.
Chemická vazba je silová interakce poutající k sobě dva atomy, je realizována sdílením valenčních elektronů. Běžně se setkáváme s vazbami tvořenými jedním až třemi elektronovými páry (jednoduchá až trojná vazba). U sloučenin přechodných kovů známe i vyšší vazebné řády.
Důležité pojmy
Chemická vazba je charakterizována vazebnou energií a délkou vazby. Vazebná energie je energie potřebná k roztržení vazby, má stejnou hodnotu, ale opačné znaménko jako energie, která se uvolní při vzniku vazby. Délka vazby je vzdálenost mezi středy atomů tvořících vazbu.
Čím má vazba vyšší řád, tím se zvyšuje vazebná energie a zkracuje délka vazby.
Přechodné kovy jsou kovy 3.-12. skupiny PSP.
Čtverná vazba
Čtverná vazba byla poprvé pozorována u sloučeniny K2[Re2Cl8] syntetizované už roku 1965. Je tvořena jednou vazbou sigma, dvě vazbami pí a jednou vazbou typu delta.
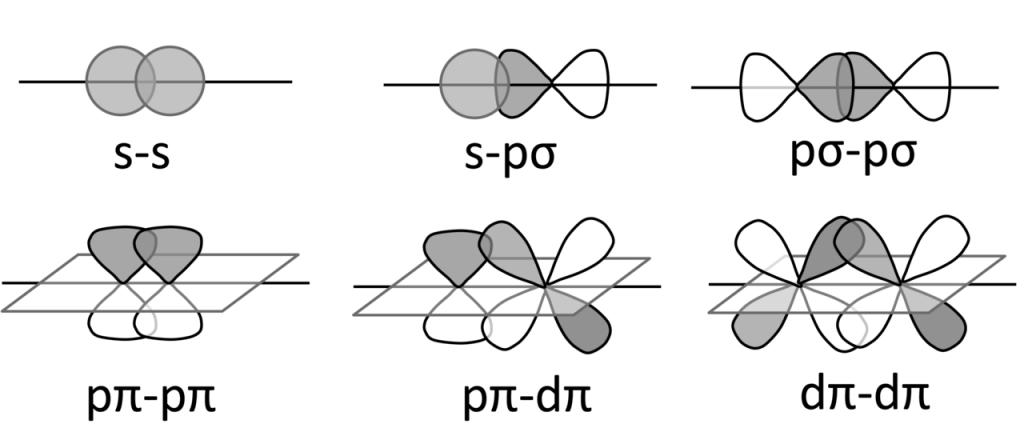
Vazba δ vzniká překryvem čtyř laloků d-orbitalů.

Čtverná vazba Fe≣C
Vznik čtverné vazby u nepřechodných prvků je obtížný, protože nemají k dispozici d-orbitaly, z toho důvodu známe maximálně trojnou vazbu. Čtverná vazby je předpokládána u hypotetické molekuly C2 a dalších izoelektronových molekul a iontů, např. CN+. V roce 2019 byla připravena sloučenina s iontem BFe(CO)3–, u které byla prokázána čtverná vazba mezi atomy boru a železa.[3] Symetrie iontu byla C3v.
Kvantově-chemickými výpočty byla potvrzena možnost existence podobné sloučeniny s uhlíkem, CFe(CO)3. Délka vazby je menší než odpovídající trojná vazba C≡Fe.
| Sloučenina | H3C-Fe(CO)3 | H2C=Fe(CO)3 | HC≡Fe(CO)3 | C≣Fe(CO)3 |
| Délka vazby Fe-C [Å] | 2,086 | 1,693 | 1,621 | 1,481 |
Protože uhlík nemá k dispozici d-orbitaly, je čtverná vazba tvořena kombinací dvou vazeb σ a dvou vazeb π.
