Křemík (lat. Silicium) je polokovový prvek, hojně se vyskytující v zemské kůře. Slouží jako základní materiál pro výrobu polovodičových součástek, ale i jako surovina pro výrobu skla a významná součást keramických a stavebních materiálů.
| Atomové číslo | 14 | Počet stabilních izotopů | 3 |
| Atomová hmotnost | 28,0855 | Elektronová konfigurace | [Ne] 3s2 3p2 |
| Teplota tání [°C] | 1413,85 | Teplota varu [°C] | 3264,85 |
| Elektronegativita | 1,9 | Hustota [g.cm-3] | 2,3290 |
Izotopy
Přírodní křemík se skládá ze tří izotopů, největší zastoupení má izotop 28Si. Jediným NMR aktivním izotopem je 29Si. Dále známe 20 radioizotopů.
| Izotop | Jaderný spin | Zastoupení [%] | Atomová hmotnost |
| 28 | 0 | 92,22 | 27,9769 |
| 29 | +1/2 | 4,69 | 28,9765 |
| 30 | 0 | 3,09 | 29,9738 |
31Si
Izotop 31Si se využívá pro studium procesů, ve kterých je zapojen křemík. Byl využit např. k optimalizaci zpracování křemíku v polovodičovém průmyslu.[9] Jeho poločas přeměny je 2,62 hodiny:
$$^{31}_{14}\textrm{Si}\ \rightarrow\ ^{31}_{15}\textrm{P}\ +\ ^{\ \ 0}_{-1}\beta^-$$
Připravuje se ostřelováním křemíku pomalými neutrony nebo fosforu rychlými neutrony:
$$^{30}_{14}\textrm{Si}\ +\ ^1_0\textrm{n}\ \rightarrow\ ^{31}_{14}\textrm{Si}\ +\ \gamma \\
^{31}_{15}\textrm{P}\ +\ ^1_0\textrm{n}\ \rightarrow\ ^{31}_{14}\textrm{Si}\ +\ ^1_1\textrm{p}$$
Výskyt
Křemík je druhým nejběžnějším prvkem v zemské kůře. Elementární křemík se v přírodě nevyskytuje, nejběžnější formou je křemen – oxid křemičitý, SiO2. Poprvé jej objevil, roku 1787, Antoine Lavoisier v horninách (pazourku), kdy předpokládal, že oxid křemičitý je sloučeninou dvou prvků.
Elementární křemík má strukturu diamantu a stříbřitě lesklý vzhled.
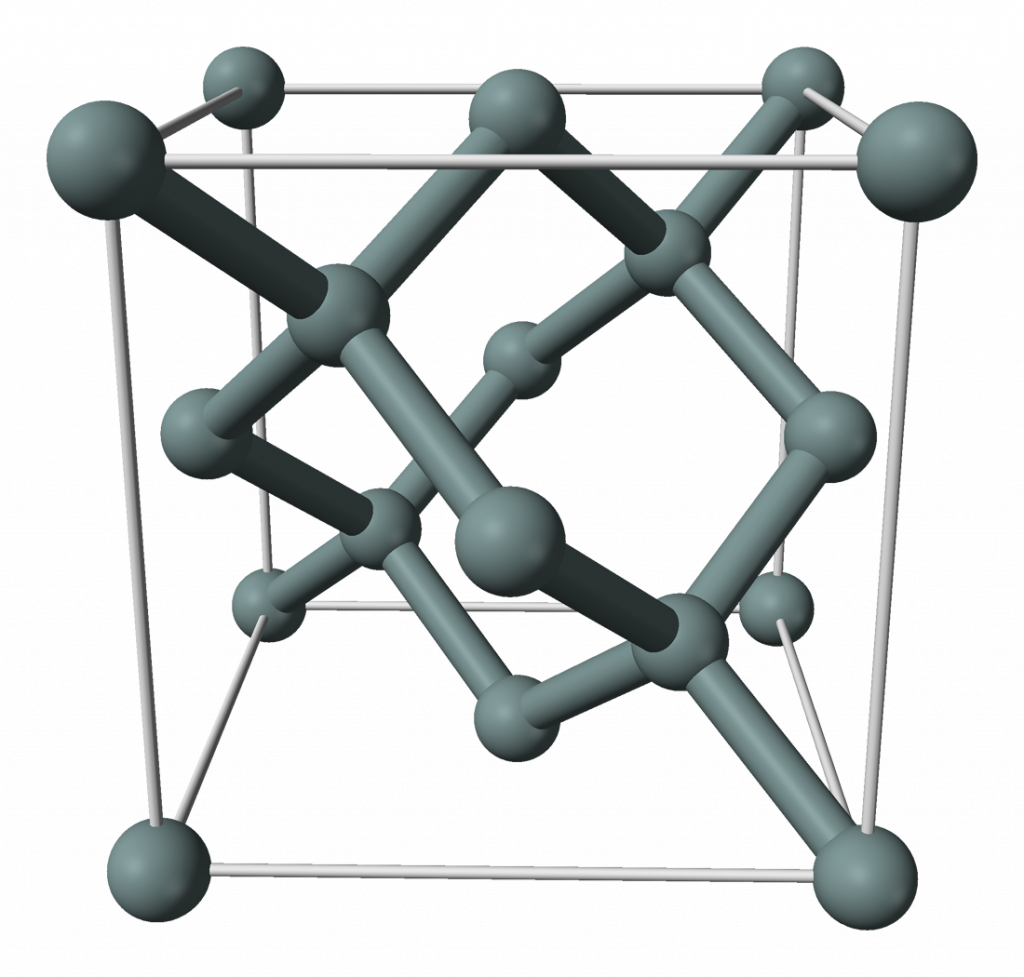

Chemické vlastnosti
Je reaktivnější než uhlík, za vysokých teplot reaguje s kyslíkem, halogeny, sírou, dusíkem, fosforem, borem i uhlíkem za vzniku binárních sloučenin. Se zásaditými roztoky reaguje za vzniku vodíku, v kyselinách se nerozpouští, jedinou výjimkou je směs kyseliny dusičné a fluorovodíkové.
Chemie silanů – binárních sloučenin křemíku s vodíkem – je poměrně rozsáhlá a zajímavá. První silany byly připraveny již roku 1857 reakcí slitiny hliníku a křemíku s kyselinou chlorovodíkovou. V současnosti známe rozvětvené i lineární silany, SinH2n+2 až po n=8. Dosud se ale nepodařilo připravit analogy nenasycených a cyklických uhlovodíků.
| Silan | Teplota tání [°C] | Teplota varu [°C] |
| SiH4 | -185 | -111,8 |
| Si2H6 | -132,5 | -14,3 |
| Si3H8 | 117,2 | 53,1 |
| Si4H10 | -89,9 | 108 |
| Iso-Si4H10 | -99,1 | 101 |
Silany jsou podstatně reaktivnější než uhlovodíky. Jejich pyrolýzou vznikají polymerní látky a při vysokých teplotách pak Si a H2. Toho se využívá při pyrolytické výrobě vysoce čistého Si z SiH4.
Tetrahalogenidy vytváří se všemi halogeny. Dihalogenidy vznikají redukcí tetrahalogenidů křemíkem za vyšší teploty, mají strukturu analogickou karbenům, jsou také silně reaktivní.
SiF2 můžeme připravit průchodem fluoridu křemičitého přes křemíkové granule za teploty vyšší než 1050 °C. Látka je stabilní pouze v plynné fázi, při ochlazení pod -70 °C vzniká červený polymer (SiF2)x.
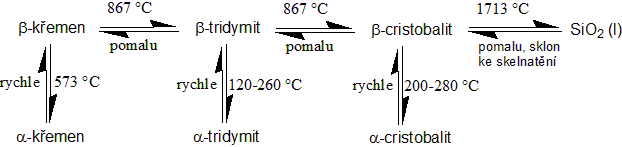
Oxid křemičitý
Oxid křemičitý, SiO2, je pevná látka, vyskytuje se ve velkém množství modifikací. Většina jeho modifikací je sestavena z tetraedrů SiO4, které jsou propojeny přes atom kyslíku (vrchol tetraedru). Známe tři modifikace stabilní za atmosférického tlaku.
- Křemen – nízkoteplotní modifikace, je stabilní do teploty 870 °C
- Tridymit – vysokoteplotní modifikace. Známe sedm krystalických forem.
- Kristobalit – vysokoteplotní modifikace. Je stabilní pouze nad teplotou 1470 °C.
Chemicky je oxid křemičitý poměrně inertní. Rozpouští se pouze v kyselině fluorovodíkové a koncentrovaných alkalických hydroxidech. Za vyšší teploty reaguje i s uhlíkem a vodíkem.
SiO2 + 4 HF → SiF4 + 2 H2O
SiO2 + 6 HF → H2SiF6 + 2 H2O
Jednou z důležitých aplikací je křemenné sklo, které je chemicky i tepelně velmi odolné. Vydrží velké teplotní šoky, má totiž malý koeficient tepelné roztažnosti. Využívá se i pro výrobu kyvet pro UV/VIS spektrofotometrii.

V roce 2020 byla objevena nová forma oxidu křemičitého vznikající během dopadu meteoritů.[7,8]
Silikony
Polysiloxany (triviálně silikony) jsou polymery tvořené řetězcem, kde se střídají atomy křemíku a kyslíku, jejich obecný vzorec je [R2SiO]n, kde R je organický substituent.
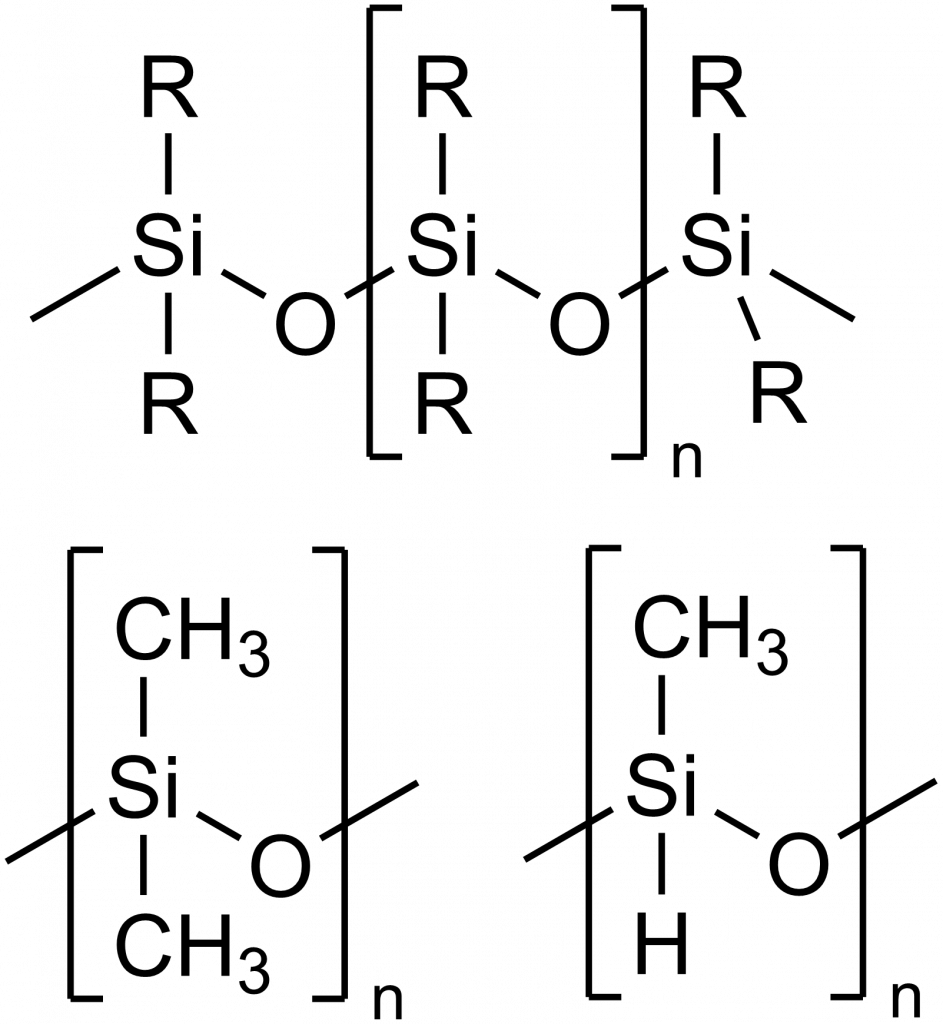
Se silikony se běžně potkáváme v domácnosti, např. ve formě těsnění u umyvadel, teplodolných laků a dalších aplikací. Ještě širší využití nachází v průmyslu.

Nejběžnějším silikonem je polydimethylsiloxan (PDMS, viz obrázek výše), ten se připravuje hydrolýzou dimethyldichlorosilanu:
n Si(CH3)2Cl2 + (n+1) H2O → HO[Si(CH3)2O]nH + 2n HCl
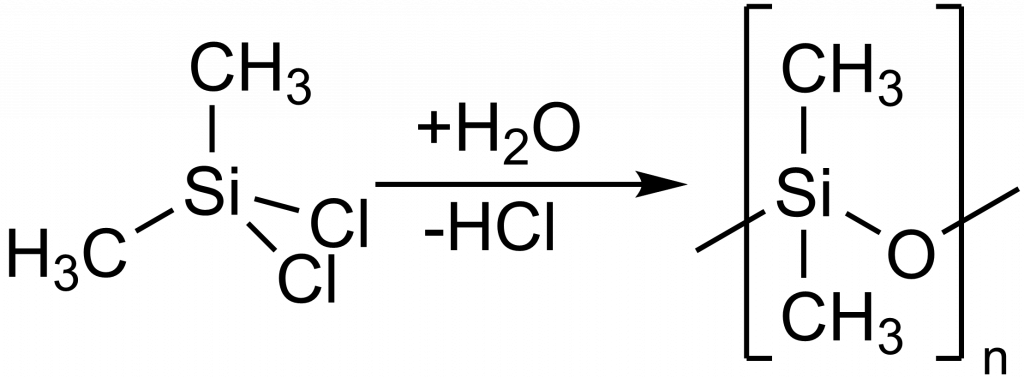
Nitrid křemičitý
Nitrid křemičitý, Si3N4, je keramický materiál využívaný jak v automobilovém průmyslu, tak i v elektronice. Připravuje se reakcí chloridu křemičitého s amoniakem, nejprve dochází ke vzniku amidu, ten se následně termicky rozkládá na imid a nitrid.
SiCl4 + 4 NH3 → Si(NH2)4 → Si(NH)2 → Si3N4

V elektronice se využívá nitrid křemičitý hlavně ve formě filmů, které se připravují pomocí CVD nebo PECVD.
Další sloučeniny křemíku
V roce 2023 byla publikována příprava silapyramidanu a jeho derivátů.
Zajímavou skupinou sloučenin jsou i silafullerany, analogy uhlíkových fullerenů.
Využití
Křemík má obrovské využití, setkáváme se s ním doslova na každém kroku. Čistý křemík má nezastupitelnou roli v polovodičích, křemík ve formě ferrosilicia (slitina FeSi) se využívá v ocelářském průmyslu. S oxidem křemičitým se setkáváme ve sklech, keramice, silikagelu, ale také třeba ve stavebních materiálech, i v žáruvzdorných cihlách.
NMR
Přírodní křemík je tvořen třemi stabilními izotopy (28, 29 a 30), z nichž je pouze jeden aktivní v NMR – 29Si. Jeho přirozené zastoupení je 4,7 % a má jaderný spin 1/2.
| 29Si | |
|---|---|
| Spin | 1/2 |
| Zastoupení v přírodě [%] | 4,6832 |
| Rozsah chemických posunů | -346 – 173 |
| Citlivost vzhledem k 1H | 0,00786 |
| Citlivost vzhledem k 13C | 2,16 |
| Rezonanční frekvence v poli 1 T | 8,4655 |
| Gyromagnetický poměr | -0.55529 |
Citlivost je srovnatelná s 13C NMR, ale relaxační časy jsou podstatně delší. Na běžné měření s 90° pulsem, u kapalných i pevných vzorků, je nutné nastavit čas D1 minimálně na 5 s. Standardem je roztok TMS (tetramethylsilan), v pevné fázi se často využívá DSS (3-(trimethylsilyl)-propansulfonová kyselina).
Chemické posuny
| Sloučenina | Chemické posuny [ppm] |
| Silyly přechodných kovů | 170 – -90 |
| Silany | 20 – -130 |
| TMS | 0 |
| Halogenidy křemíku | -50 – -350 |
| Silikáty | -50 – -120 |
| Šestikoordinovaný křemík | -120 – -200 |
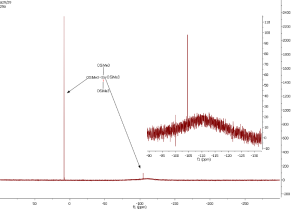
Spektrum tetrakis(trimethylsilyl)silanu
Já používám jako standard pro 29Si NMR roztok Si(OSiMe3)4 v C6D6. Ve spektru jsou dva signály, intenzivnější patří trimethylsiloxy- skupinám, druhý signál patří centrálnímu atomu křemíku, pod ním je vidět široký signál pocházející ze skla NMR kyvety.
Odkazy
- Křemík na české wikipedii
- Křemík na anglické wikipedii
- Nový allotrop křemíku
- Chemistry of low valent silicon – Roesky, H.W.; J. Organomet. Chem. 2013, 730, 57-62
- Trojná vazba mezi osmiem a křemíkem
- Silicon NMR
- Structural response of α-quartz under plate-impact shock compression
- Meteorite strikes may create unexpected form of silica
- HÁLA, Jiří. Radioaktivní izotopy. Tišnov: Sursum, 2013. ISBN 978-80-7323-248-1.
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
prohozena teplota tání a teplota varu elementárního křemíku.
Díky za upozornění, opraveno.